网址:http://m.1010jiajiao.com/timu3_id_49604[举报]
孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O的步骤如下:
|

 为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:| 物质 | pH (开始沉淀) | pH(完全沉淀) |
| Fe(OH)3 | 1.9 | 3.2 |
| Fe(OH)2 | 7.0 | 9.0 |
| Cu(OH)2 | 4.7 | 6.7 |
,需调节溶液pH的范围为 。
(2)操作X包括 蒸发浓缩、冷却结晶、过滤和洗涤等。在进行该操作时,需要将溶液B再
适当酸化目的 。
(3)若向溶液B中逐滴加入NaOH溶液,刚好出现沉淀时,请写出存在的难溶物质的沉淀溶解平衡方程式为
(4) 为准确测定溶液A中含有Fe2+的物质的量浓度,实验如下:
①取出25.00mL溶液A,配制成250 mL 溶液。
②滴定:准确量取25.00ml所配溶液于锥形瓶中,将0.20mol/LKMnO4溶液
装入 ,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
(反应式: 5Fe2+ + MnO4— +10 H+ = 5Fe3+ + Mn2+ + 5H2O)
③ 计算溶液A中Fe2+的物质的量浓度= mol/L (只列出算式,不做运算)。 查看习题详情和答案>>
孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O的步骤如下:
|


为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
|
物质 |
pH (开始沉淀) |
pH(完全沉淀) |
|
Fe(OH)3 |
1.9 |
3.2 |
|
Fe(OH)2 |
7.0 |
9.0 |
|
Cu(OH)2 |
4.7 |
6.7 |
(1)“除杂”时先通入足量H2O2将Fe2+氧化成Fe3+,再加入CuO固体。其中加入CuO作用是
,需调节溶液pH的范围为 。
(2)操作X包括 蒸发浓缩、冷却结晶、过滤和洗涤等。在进行该操作时,需要将溶液B再
适当酸化目的 。
(3)若向溶液B中逐滴加入NaOH溶液,刚好出现沉淀时,请写出存在的难溶物质的沉淀溶解平衡方程式为
(4) 为准确测定溶液A中含有Fe2+的物质的量浓度,实验如下:
①取出25.00mL溶液A,配制成250 mL 溶液。
②滴定:准确量取25.00ml所配溶液于锥形瓶中,将0.20mol/LKMnO4溶液
装入 ,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
(反应式: 5Fe2+ + MnO4— +10 H+ = 5Fe3+ + Mn2+ + 5H2O)
③ 计算溶液A中Fe2+的物质的量浓度= mol/L (只列出算式,不做运算)。
查看习题详情和答案>>
 (2012?成都模拟)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0
(2012?成都模拟)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)?2NH3(g)△H<0其化学平衡常数K与温度t的关系如下表,完成下列问题.
| t/℃ | 25 | 125 | 225 | … |
| K | 4.1×105 | K1 | K2 | … |
| c2(NH3) |
| c3(H2)×c(N2) |
| c2(NH3) |
| c3(H2)×c(N2) |
(2)判断该反应达到化学平衡状态的依据是
A.2VH2(正)=3VNH3(逆)
B.N2的消耗速率等于H2的消耗速率
C. 溶器内压强保持不变
D.混合气体的密度保持不变
E.容器中气体的平均相对分子质量不随时间而变化
F.混合气体的颜色保持不变
(3)将不同量的N2和H2分别通入到体积为2L的恒容密闭容器中,进行上述反应得到如下两组数据:
| 实验组 | 温度(℃) | 起始量(mol) | 平衡量(mol) | 达到平衡所需时间(min) | |
| N2 | H2 | NH3 | |||
| 1 | 650 | 2 | 4 | 0.9 | 9 |
| 2 | 900 | 1 | 2 | 0.3 | 0.01 |
(4)有人设计采用高性能质子导电材料SCY陶瓷(能传递H+),实现了常压下既能合成氨又能发电的实验装置(如图).则其正极的电极反应为
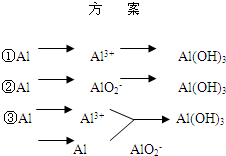 实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,
实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,(1)用方案 ①制备Al(OH)3时使用的药品最好是铝屑、稀硫酸和氨水,不用氢氧化钠代替氨水的原因是
(2)用方案 ②来制备Al(OH)3时,必须注意
(3)完成下表
| 方 案 | 生成1mol Al(OH)3消耗H+ 或 OH- 的物质的量/mol | |||||
| 消耗H+ | 消耗OH- | |||||
| ① | 3 | 3 3 | ||||
| ② | 1 1 |
1 | ||||
| ③ | 3/4 |
| ||||

回答下列问题:
(1)加入CuO的作用是

(2)步骤②中所用的部分仪器如图所示,则A、B分别连直流电源的
(填“正”或“负”).
(3)电解开始后,电解的离子方程式为
| ||
| ||
(4)下列实验操作中必要的是
A.称量电解前的电极的质量;
B.电解后,电极在烘干称量前,必须用蒸馏水冲洗;
C.刮下电解后电极上析出的铜,并清洗,称量;
D.电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行;
E.在有空气存在的情况下,烘干电极必须用低温烘干的方法.
(5)铜的相对原子质量为
| 11200m |
| V |
| 11200m |
| V |