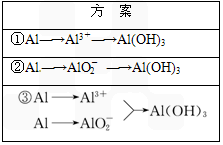
题目内容
 实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,
实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,(1)用方案 ①制备Al(OH)3时使用的药品最好是铝屑、稀硫酸和氨水,不用氢氧化钠代替氨水的原因是
若用NaOH溶液沉淀Al3+,终点不易控制,因为Al(OH)3会溶于过量的NaOH溶液,从而影响Al(OH)3的生成量
若用NaOH溶液沉淀Al3+,终点不易控制,因为Al(OH)3会溶于过量的NaOH溶液,从而影响Al(OH)3的生成量
;写出该方案中有关的离子方程式:2Al+6H+=2Al3++3H2↑、Al3++3NH3?H2O=Al(OH)3↓+3NH4+
2Al+6H+=2Al3++3H2↑、Al3++3NH3?H2O=Al(OH)3↓+3NH4+
.(2)用方案 ②来制备Al(OH)3时,必须注意
稀硫酸
稀硫酸
的用量,以防止生成的Al(OH)3溶解.(3)完成下表
| 方 案 | 生成1mol Al(OH)3消耗H+ 或 OH- 的物质的量/mol | |||||
| 消耗H+ | 消耗OH- | |||||
| ① | 3 | 3 3 | ||||
| ② | 1 1 |
1 | ||||
| ③ | 3/4 |
| ||||
③
③
(填序号),原因是药品用量少,操作最为简单
药品用量少,操作最为简单
.分析:(1)金属能与酸反应,生成的盐能与碱反应来生成氢氧化铝,并注意氢氧化铝的两性来分析;
(2)根据硫酸过量时能溶解氢氧化铝来分析;
(3)根据生成1molAl(OH)3,利用每种方案中的化学反应来分析.
(2)根据硫酸过量时能溶解氢氧化铝来分析;
(3)根据生成1molAl(OH)3,利用每种方案中的化学反应来分析.
解答:解:(1)铝与硫酸反应生成硫酸铝和氢气,硫酸铝与氨水反应生成氢氧化铝,且氨水过量也不会与氢氧化铝反应,但是若用NaOH溶液沉淀Al3+,终点不易控制,因为Al(OH)3会溶于过量的NaOH溶液,从而影响Al(OH)3的生成量,方案①中的离子反应为2Al+6H+=2Al3++3H2↑、Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
故答案为:若用NaOH溶液沉淀Al3+,终点不易控制,因为Al(OH)3会溶于过量的NaOH溶液,从而影响Al(OH)3的生成量;2Al+6H+=2Al3++3H2↑、Al3++3NH3?H2O=Al(OH)3↓+3NH4+;(2)方案②来制备Al(OH)3时,铝先与碱反应生成偏铝酸根离子,然后偏铝酸根离子与酸反应生成氢氧化铝,但硫酸能溶解氢氧化铝,则应控制硫酸的用量,故答案为:稀硫酸;
(3)都生成1molAl(OH)3时,由反应方程式可知
方案①中:2Al+6H+=2Al3++3H2↑、Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
3 1 1 3 1
即生成1molAl(OH)3时,消耗3molH+、3molOH-,
方案②中:2Al+2NaOH+2H2O=2NaAlO2+3H2↑、AlO2-+H2O+H+=Al(OH)3↓,
1 1 1 1 1 1
即生成1molAl(OH)3时,消耗1molH+、1molOH-,
方案③中:2Al+6H+=2Al3++3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑、Al3++3AlO2-+6H2O=4Al(OH)3↓,
1
即生成1molAl(OH)3时,消耗
molH+、
molOH-,
显然方案③最好,药品用量少,操作最为简单,
故答案为:3;1;
;③;药品用量少,操作最为简单.
故答案为:若用NaOH溶液沉淀Al3+,终点不易控制,因为Al(OH)3会溶于过量的NaOH溶液,从而影响Al(OH)3的生成量;2Al+6H+=2Al3++3H2↑、Al3++3NH3?H2O=Al(OH)3↓+3NH4+;(2)方案②来制备Al(OH)3时,铝先与碱反应生成偏铝酸根离子,然后偏铝酸根离子与酸反应生成氢氧化铝,但硫酸能溶解氢氧化铝,则应控制硫酸的用量,故答案为:稀硫酸;
(3)都生成1molAl(OH)3时,由反应方程式可知
方案①中:2Al+6H+=2Al3++3H2↑、Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
3 1 1 3 1
即生成1molAl(OH)3时,消耗3molH+、3molOH-,
方案②中:2Al+2NaOH+2H2O=2NaAlO2+3H2↑、AlO2-+H2O+H+=Al(OH)3↓,
1 1 1 1 1 1
即生成1molAl(OH)3时,消耗1molH+、1molOH-,
方案③中:2Al+6H+=2Al3++3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑、Al3++3AlO2-+6H2O=4Al(OH)3↓,
| 3 |
| 4 |
| 1 |
| 4 |
| 3 |
| 4 |
| 3 |
| 4 |
| 1 |
| 4 |
| 3 |
| 4 |
即生成1molAl(OH)3时,消耗
| 3 |
| 4 |
| 3 |
| 4 |
显然方案③最好,药品用量少,操作最为简单,
故答案为:3;1;
| 3 |
| 4 |
点评:本题考查氢氧化铝的制备,明确铝及氢氧化铝的性质即可解答,学生应学会根据化学反应方程式来分析设计方案的优劣,注重节约能源、原料易得、环保等问题来分析.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
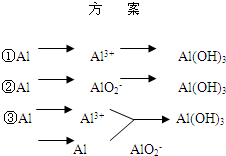
 实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,
实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,
(1)用方案 ①制备Al(OH)3时使用的药品最好是铝屑、稀硫酸和氨水,不用氢氧化钠代替氨水的原因是______;写出该方案中有关的离子方程式:______.
(2)用方案 ②来制备Al(OH)3时,必须注意______ 的用量,以防止生成的Al(OH)3溶解.
(3)完成下表
| 方 案 | 生成1mol Al(OH)3消耗H+ 或 OH- 的物质的量/mol | |
| 消耗H+ | 消耗OH- | |
| ① | 3 | ______ |
| ② | ______ | 1 |
| ③ | 3/4 | ______ |
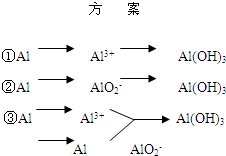
实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,
| 方 案 |
|
|
|
|
|
|
(1)用方案 ① 制备Al(OH)3时使用的药品最好是铝屑、稀硫酸和氨水,不用氢氧化钠代替氨水的原因是
;
写出该方案中有关的离子方程式:
。
(2)用方案 ② 来制备Al(OH)3时,必须注意 的用量, 以防止生成的Al(OH)3溶解。
(3)完成下表
| 方 案 | 生成1mol Al(OH)3消耗H+ 或 OH- 的物质的量/ mol | |
| 消耗H+ | 消耗OH- | |
| ① | 3 | |
| ② |
1 | |
| ③ | 3/4 | |
(4)三种方案中,你认为最好的是 (填序号),原因是
。
实验室可用铝屑、氨水、氢氧化钠溶液、稀硫酸等来制备氢氧化铝,某同学设计了三种方案,
(1)用方案 ①制备Al(OH)3时使用的药品最好是铝屑、稀硫酸和氨水,不用氢氧化钠代替氨水的原因是______;写出该方案中有关的离子方程式:______.
(2)用方案 ②来制备Al(OH)3时,必须注意______ 的用量,以防止生成的Al(OH)3溶解.
(3)完成下表
三种方案中,你认为最好的是______ (填序号),原因是______.
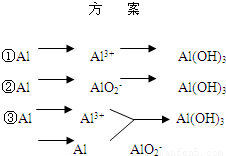
(1)用方案 ①制备Al(OH)3时使用的药品最好是铝屑、稀硫酸和氨水,不用氢氧化钠代替氨水的原因是______;写出该方案中有关的离子方程式:______.
(2)用方案 ②来制备Al(OH)3时,必须注意______ 的用量,以防止生成的Al(OH)3溶解.
(3)完成下表
| 方 案 | 生成1mol Al(OH)3消耗H+ 或 OH- 的物质的量/mol | |
| 消耗H+ | 消耗OH- | |
| ① | 3 | ______ |
| ② | ______ | 1 |
| ③ | 3/4 | ______ |