摘要:( 4×l0-3 mol / L)
网址:http://m.1010jiajiao.com/timu3_id_49472[举报]
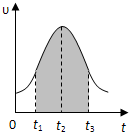 I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.回答如下问题:
I.实验测得0.01mol/L的KMnO4的硫酸溶液和0.1mol/L的H2C2O4溶液等体积混合后,反应速率υ[mol/(L?s)]与反应时间t(s)的关系如图所示.回答如下问题:(1)该反应的化学方程式:
2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
(2)0→t2时间段内反应速率增大的原因是:
反应放热,温度升高,反应速率加快
反应放热,温度升高,反应速率加快
,(3)t2→t时间段内反应速率减小的原因是:
反应物浓度降低,导致反应速率降低
反应物浓度降低,导致反应速率降低
,(4)图中阴影部分“面积”表示t1→t3时间里
AD
AD
.A.Mn2+物质的量浓度的增大 B.Mn2+物质的量的增加
C.SO42-物质的量浓度 D.MnO4-物质的量浓度的减小
Ⅱ.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
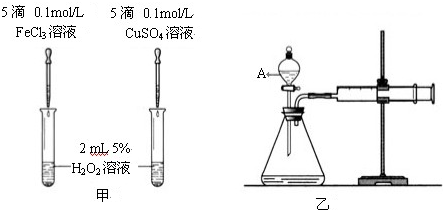
(1)定性分析:如图甲可观察
产生气泡的快慢
产生气泡的快慢
,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是消除阴离子不同对实验的干扰
消除阴离子不同对实验的干扰
.(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.图中仪器A的名称为
分液漏斗
分液漏斗
,实验中需要测量的数据是产生40mL气体所需的时间
产生40mL气体所需的时间
(3)加入0.01mol MnO2粉末于60mL H2O2溶液中,在标准状况下放出气体体积和时间的关系如图所示.设放出气体的总体积为V mL.
①放出
| V | 3 |
1
1
min.②该H2O2溶液的浓度为
0.09mol/L
0.09mol/L
③A、B、C、D各点反应速率快慢的顺序为
D
D
>C
C
>B
B
>A
A
.
已知t℃时,Ksp[Al(OH)3]=l×l0-33,Ksp[Mg(OH)2]=4×10-12。在含有0.20 mol/L H+且c(Mg2+)=c(A13+)=0.10mol/L的溶液中不断加入KOH溶液,沉淀的质量m(沉淀)与加入KOH溶液的体积V[KOH(aq)]关系的示意图正确的是( )

查看习题详情和答案>>
已知t℃时,Ksp[Al(OH)3]=l×l0-33,Ksp[Mg(OH)2]=4×10-12。在含有0.20 mol/L H+且c(Mg2+)=c(A13+)=0.10mol/L的溶液中不断加入KOH溶液,沉淀的质量m(沉淀)与加入KOH溶液的体积V[KOH(aq)]关系的示意图正确的是( )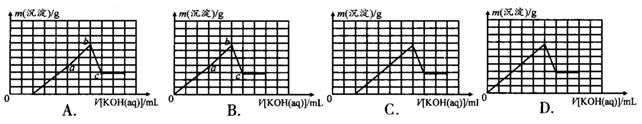
已知t℃时,Ksp[Al(OH)3]=l×l0-33,Ksp[Mg(OH)2]=4×10-12。在含有0.20 mol/L H+且c(Mg2+)=c(A13+)=0.10mol/L的溶液中不断加入KOH溶液,沉淀的质量m(沉淀)与加入KOH溶液的体积V[KOH(aq)]关系的示意图正确的是( )


(1)SO2的摩尔质量是
(2)为防止氯气尾气污染空气,根据氯气的性质,可用
(3)将一小块金属钠投入水中,发生反应的化学方程式为
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(4)1.5mol CO2中含
(5)在一定温度和压强下,5体积气体A2跟15体积的气体B2完全化合生成10体积某气体C,则该气体C的化学式为(用A、B表示)
查看习题详情和答案>>
64g/mol
64g/mol
; 0.1molCO2的质量是4.4
4.4
g,它在标准状况是的体积约为2.24
2.24
L;在0.5L 0.2mol/L的 Ba(NO3)2溶液中NO3-的物质的量浓度为0.4mol/L
0.4mol/L
.(2)为防止氯气尾气污染空气,根据氯气的性质,可用
氢氧化钠
氢氧化钠
溶液吸收多余的氯气,原理是(用化学方程式表示)2NaOH+Cl2=NaClO+NaCl+H2O
2NaOH+Cl2=NaClO+NaCl+H2O
. 根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是Ca(ClO)2
Ca(ClO)2
(填化学式),长期露置于空气中的漂白粉会失效的原因,用化学反应方程式可表示为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
.(3)将一小块金属钠投入水中,发生反应的化学方程式为
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
;可观察到的实验现象是bc
bc
(填序号).a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(4)1.5mol CO2中含
1.5
1.5
mol碳原子,3NA
3NA
个氧原子(以NA为阿伏加德罗常数的值),标准状况下的体积为33.6
33.6
L.(5)在一定温度和压强下,5体积气体A2跟15体积的气体B2完全化合生成10体积某气体C,则该气体C的化学式为(用A、B表示)
AB3或B3A
AB3或B3A
.