摘要:13.2A1+2NaOH+2H2O===2NaAlO2+3H2↑ mol 本资料由 提供!
网址:http://m.1010jiajiao.com/timu3_id_49459[举报]
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案进行探究.填写下列空白.
【探究一】
实验方案:铝镁合金
测定剩余固体质量
问题讨论:
(1)称取一定质量的铝镁合金粉末样品,加入过量的NaOH溶液,充分反应.实验中发生反应的化学方程式是
(2)过滤、洗涤、干燥、称量剩余固体.若未洗涤固体,测得镁的质量分数将
【探究二】
实验方案:铝镁合金
测定生成气体的体积
实验装置:
问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个装有碱石灰的干燥装置.你的意见是:
(2)为准确测定生成气体的体积,实验中应注意的问题是(只要求写出其中一点):
【探究三】
实验方案:称量x g铝镁合金粉末,放在如右图所示装置的惰性电热板上,通电使其充分灼烧.
问题讨论:
(1)欲计算Mg的质量分数,该实验中还需测定的数据是
(2)若用空气代替O2进行实验,对测定结果是否有影响?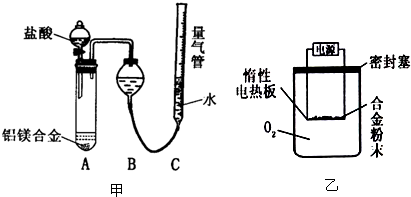
查看习题详情和答案>>
【探究一】
实验方案:铝镁合金
| 氢氧化钠溶液 |
问题讨论:
(1)称取一定质量的铝镁合金粉末样品,加入过量的NaOH溶液,充分反应.实验中发生反应的化学方程式是
2A1+2NaOH+2H2O═2NaA1O2+3H2↑(或2A1+2NaOH+6H2O=2Na[A1(OH)4]+3H2↑)
2A1+2NaOH+2H2O═2NaA1O2+3H2↑(或2A1+2NaOH+6H2O=2Na[A1(OH)4]+3H2↑)
.(2)过滤、洗涤、干燥、称量剩余固体.若未洗涤固体,测得镁的质量分数将
偏高
偏高
(填“偏高”或“偏低”).【探究二】
实验方案:铝镁合金
| 盐酸 |
实验装置:
问题讨论:
(1)某同学提出该实验装置不够完善,应在A、B之间添加一个装有碱石灰的干燥装置.你的意见是:
不需要
不需要
(填“需要”或“不需要”).(2)为准确测定生成气体的体积,实验中应注意的问题是(只要求写出其中一点):
检查装置的气密性(或合金完全溶解,或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平等合理答案)
检查装置的气密性(或合金完全溶解,或加入足量盐酸,或调整量气管C的高度,使C中液面与B液面相平等合理答案)
【探究三】
实验方案:称量x g铝镁合金粉末,放在如右图所示装置的惰性电热板上,通电使其充分灼烧.
问题讨论:
(1)欲计算Mg的质量分数,该实验中还需测定的数据是
灼烧后固体的质量
灼烧后固体的质量
.(2)若用空气代替O2进行实验,对测定结果是否有影响?
是
是
(填“是”或“否”).
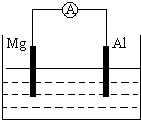 如图所示装置
如图所示装置(1)若烧杯中为稀H2SO4,两极反应式为:
正极
2H++2e-=H2↑
2H++2e-=H2↑
负极
Mg-2e-=Mg2+
Mg-2e-=Mg2+
总反应方程式
Mg+H2SO4=MgSO4+H2↑
Mg+H2SO4=MgSO4+H2↑
(2)若烧杯中为NaOH溶液,总反应方程式为:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.图中A~I分别表示化学反应中的一种常见物质,工业上常用电解A的饱和溶液的方法制取B.其中E、F、J在通常情况下是气体单质,E为有色气体,J是空气中含量最多的气体,X是一种常见的金属单质.部分产物和反应条件略去.
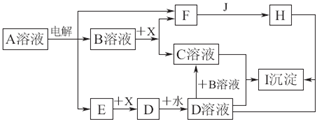
填写下列空白:
(1)写出电解A溶液的化学方程式:
(2)若将a mol D全部转化为C,则B的物质的量的取值范围为
(3)写出下列反应的离子方程式:
H+D→I:
B+X→C+F:
E与B溶液的反应:
查看习题详情和答案>>

填写下列空白:
(1)写出电解A溶液的化学方程式:
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
| ||
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
,电解过程中,向两极溶液中滴加酚酞试液,有一极溶液颜色变红,则该极为
| ||
阴
阴
(填“正”、“负”、“阴”或“阳”)极,该极的电极反应为2H++2e-═H2↑
2H++2e-═H2↑
.(2)若将a mol D全部转化为C,则B的物质的量的取值范围为
n(NaOH)≥4amol
n(NaOH)≥4amol
.(3)写出下列反应的离子方程式:
H+D→I:
3NH3?H2O+Al3+═Al(OH)3↓+3NH4+
3NH3?H2O+Al3+═Al(OH)3↓+3NH4+
;B+X→C+F:
2Al+2H2O+2OH-═2AlO2-+3H2↑
2Al+2H2O+2OH-═2AlO2-+3H2↑
;E与B溶液的反应:
Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
.(a)火药是中国的“四大发明”之一,是炎黄子孙的骄傲,也会永远激励着我们去奋发图强.黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S═K2S+2NO2↑+CO2↑.其中氧化剂是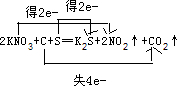
 .
.
(b)(1)按要求写出下列反应的离子方程式
①氢氧化铜溶于盐酸
②盐酸中滴加硝酸银溶液
(2)写出离子反应方程式Ba2++SO42-=BaSO4↓所对应的三个化学方程式
①
②
③
查看习题详情和答案>>
KNO3、S
KNO3、S
,还原剂是C
C
.在方程式上标出电子转移的方向和数目

(b)(1)按要求写出下列反应的离子方程式
①氢氧化铜溶于盐酸
Cu(OH)2+2H+=Cu2++2H2O
Cu(OH)2+2H+=Cu2++2H2O
②盐酸中滴加硝酸银溶液
Ag++Cl-=AgCl↓
Ag++Cl-=AgCl↓
(2)写出离子反应方程式Ba2++SO42-=BaSO4↓所对应的三个化学方程式
①
BaCl2+H2SO4=BaSO4↓+2HCl
BaCl2+H2SO4=BaSO4↓+2HCl
②
Ba(OH)2+Na2SO4=BaSO4↓+2NaOH
Ba(OH)2+Na2SO4=BaSO4↓+2NaOH
③
BaCl2+Na2SO4=BaSO4↓+2NaCl
BaCl2+Na2SO4=BaSO4↓+2NaCl
.