题目内容
(a)火药是中国的“四大发明”之一,是炎黄子孙的骄傲,也会永远激励着我们去奋发图强.黑火药在发生爆炸时,发生如下的反应:2KNO3+C+S═K2S+2NO2↑+CO2↑.其中氧化剂是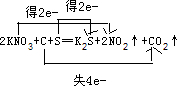
 .
.
(b)(1)按要求写出下列反应的离子方程式
①氢氧化铜溶于盐酸
②盐酸中滴加硝酸银溶液
(2)写出离子反应方程式Ba2++SO42-=BaSO4↓所对应的三个化学方程式
①
②
③
KNO3、S
KNO3、S
,还原剂是C
C
.在方程式上标出电子转移的方向和数目

(b)(1)按要求写出下列反应的离子方程式
①氢氧化铜溶于盐酸
Cu(OH)2+2H+=Cu2++2H2O
Cu(OH)2+2H+=Cu2++2H2O
②盐酸中滴加硝酸银溶液
Ag++Cl-=AgCl↓
Ag++Cl-=AgCl↓
(2)写出离子反应方程式Ba2++SO42-=BaSO4↓所对应的三个化学方程式
①
BaCl2+H2SO4=BaSO4↓+2HCl
BaCl2+H2SO4=BaSO4↓+2HCl
②
Ba(OH)2+Na2SO4=BaSO4↓+2NaOH
Ba(OH)2+Na2SO4=BaSO4↓+2NaOH
③
BaCl2+Na2SO4=BaSO4↓+2NaCl
BaCl2+Na2SO4=BaSO4↓+2NaCl
.分析:(a)2KNO3+C+S═K2S+2NO2↑+CO2↑中,N、S元素的化合价降低,C元素的化合价升高,该反应中转移电子数为4e-;
(b)(1)①反应生成氯化铜和水,氢氧化铜、水在离子反应中保留化学式;
②反应生成氯化银和硝酸,氯化银在离子反应中保留化学式;
(2)可溶性钡盐(或碱)和可溶性盐(或酸)反应生成硫酸钡和可溶性盐(或强酸、强碱)的离子反应为Ba2++SO42-=BaSO4↓.
(b)(1)①反应生成氯化铜和水,氢氧化铜、水在离子反应中保留化学式;
②反应生成氯化银和硝酸,氯化银在离子反应中保留化学式;
(2)可溶性钡盐(或碱)和可溶性盐(或酸)反应生成硫酸钡和可溶性盐(或强酸、强碱)的离子反应为Ba2++SO42-=BaSO4↓.
解答:解:2KNO3+C+S═K2S+2NO2↑+CO2↑中,N、S元素的化合价降低,C元素的化合价升高,则氧化剂为KNO3、S,还原剂为C,该反应中转移电子数为4e-;,则转移的电子方向和数目为 ,故答案为:KNO3、S;C;
,故答案为:KNO3、S;C; ;
;
(b)(1)①反应生成氯化铜和水,氢氧化铜、水在离子反应中保留化学式,离子反应为Cu(OH)2+2H+=Cu2++2H2O,故答案为:Cu(OH)2+2H+=Cu2++2H2O;
②反应生成氯化银和硝酸,氯化银在离子反应中保留化学式,离子反应为Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓;
(2)可溶性钡盐(或碱)和可溶性盐(或酸)反应生成硫酸钡和可溶性盐(或强酸、强碱)的离子反应为Ba2++SO42-=BaSO4↓,符合条件的反应如
①BaCl2+H2SO4=BaSO4↓+2HCl、②Ba(OH)2+Na2SO4=BaSO4↓+2NaOH、③BaCl2+Na2SO4=BaSO4↓+2NaCl,
故答案为:BaCl2+H2SO4=BaSO4↓+2HCl;Ba(OH)2+Na2SO4=BaSO4↓+2NaOH;BaCl2+Na2SO4=BaSO4↓+2NaCl.
 ,故答案为:KNO3、S;C;
,故答案为:KNO3、S;C; ;
;(b)(1)①反应生成氯化铜和水,氢氧化铜、水在离子反应中保留化学式,离子反应为Cu(OH)2+2H+=Cu2++2H2O,故答案为:Cu(OH)2+2H+=Cu2++2H2O;
②反应生成氯化银和硝酸,氯化银在离子反应中保留化学式,离子反应为Ag++Cl-=AgCl↓,故答案为:Ag++Cl-=AgCl↓;
(2)可溶性钡盐(或碱)和可溶性盐(或酸)反应生成硫酸钡和可溶性盐(或强酸、强碱)的离子反应为Ba2++SO42-=BaSO4↓,符合条件的反应如
①BaCl2+H2SO4=BaSO4↓+2HCl、②Ba(OH)2+Na2SO4=BaSO4↓+2NaOH、③BaCl2+Na2SO4=BaSO4↓+2NaCl,
故答案为:BaCl2+H2SO4=BaSO4↓+2HCl;Ba(OH)2+Na2SO4=BaSO4↓+2NaOH;BaCl2+Na2SO4=BaSO4↓+2NaCl.
点评:本题考查离子反应的书写,侧重氧化还原反应离子反应、化学反应的考查,明确反应中元素的化合价变化及离子反应的书写方法即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目