摘要:15.甲: Al2(SO4)3 .乙:K2CO3 .丙:AgNO3 .丁:BaCl2.戊:NH4Br (2)2Al3++3CO32-+3H2O==2Al(OH)3↓+3CO2↑
网址:http://m.1010jiajiao.com/timu3_id_48867[举报]
 如图所示,当关闭阀门K时,向甲中充入1.5mol A、3.5mol B,向乙中充入3mol A、7mol B,起始时,甲、乙体积均为VL.在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
如图所示,当关闭阀门K时,向甲中充入1.5mol A、3.5mol B,向乙中充入3mol A、7mol B,起始时,甲、乙体积均为VL.在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+2B(g)═C(g)+2D(g);△H<0达到平衡(Ⅰ)时,V(乙)=0.86VL.请回答:
(1)乙中B的转化率为
20%
20%
;(2)甲中D和乙中C的物质的量比较:
后者大
后者大
(填“相等”、“前者大”、“后者大”);(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为
0.29V
0.29V
(用含V的代数式表示,连通管中气体体积忽略不计.)下列反应在210℃时达到平衡:
①PCl5(g)?PCl3(g)+Cl2(g);△H1>0 K1=1mol?L-1
②CO(g)+Cl2(g)?COCl2(g);△H1<0 K2=5×104L?mol-1
③COCl2(g)?CO(g)+Cl2(g)
④2SO2(g)+O2(g)?2SO3(g);△H4<0
(1)反应③的平衡常数K3为 .
(2)要使反应①和反应②的K数值相等,可采取的措施是 (填序号).
A.降低反应①、②体系中Cl2浓度B.反应①、②选择不同的催化剂
C.反应①、反应②同时升高温度D.反应①、反应②同时降低温度
E.反应①降低温度,反应②维持210℃
(3)在甲、乙两容器中分别发生反应④,甲恒容、乙恒压,温度相同且恒定.起始时甲中加入0.02molSO2和0.01molO2,乙中加入0.02molSO3气体,开始时两容器压强相等,最后分别达到平衡.下列有关它们达到平衡状态后的叙述正确的是 (填序号).
A.体积:甲可能小于乙
B.SO3的物质的量:甲一定小于乙
C.压强:甲可能大于乙
D.浓度比c(SO2)/c(SO3):甲一定小于乙
(4)丙容器为容积不变的反应容器,要求通过调节体系的温度使反应④达到平衡时,保持容器内气体总物质的量为12mol.现向容器中加xmolSO2,6.5mol O2,2.0molSO3.
①若x=5.5,需要 (填“降低”“升高”或“保持”)体系温度,使反应在平衡时达到题设要求;
②欲使起始反应维持向逆反应方向移动,则x的取值范围为 .
查看习题详情和答案>>
①PCl5(g)?PCl3(g)+Cl2(g);△H1>0 K1=1mol?L-1
②CO(g)+Cl2(g)?COCl2(g);△H1<0 K2=5×104L?mol-1
③COCl2(g)?CO(g)+Cl2(g)
④2SO2(g)+O2(g)?2SO3(g);△H4<0
(1)反应③的平衡常数K3为
(2)要使反应①和反应②的K数值相等,可采取的措施是
A.降低反应①、②体系中Cl2浓度B.反应①、②选择不同的催化剂
C.反应①、反应②同时升高温度D.反应①、反应②同时降低温度
E.反应①降低温度,反应②维持210℃
(3)在甲、乙两容器中分别发生反应④,甲恒容、乙恒压,温度相同且恒定.起始时甲中加入0.02molSO2和0.01molO2,乙中加入0.02molSO3气体,开始时两容器压强相等,最后分别达到平衡.下列有关它们达到平衡状态后的叙述正确的是
A.体积:甲可能小于乙
B.SO3的物质的量:甲一定小于乙
C.压强:甲可能大于乙
D.浓度比c(SO2)/c(SO3):甲一定小于乙
(4)丙容器为容积不变的反应容器,要求通过调节体系的温度使反应④达到平衡时,保持容器内气体总物质的量为12mol.现向容器中加xmolSO2,6.5mol O2,2.0molSO3.
①若x=5.5,需要
②欲使起始反应维持向逆反应方向移动,则x的取值范围为
(2011?龙岩模拟)甲、乙、丙、丁均为中学常见物质,且甲、乙、丙均含有同一种元素.一定条件下四种物质之间有如图甲所示的转化关系.请回答问题:
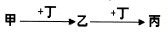
(1)若甲、丁分别为铁和氯气中的一种,则丙的酸性溶液露置于空气中将变质.变质过程所发生反应的离子方程式为
(2)已知乙、丁均为空气中含量最多的两种单质,且由甲、丁和NaOH溶液构成的新型燃料电池放电时甲与丁作用转化为乙(同时生成一种对生命活动有重要意义的物质),负极反应式为
(3)图示转化关系对应的反应既可以是非氧化还原反应,也可以是氧化还原反应.
①若丁为盐酸且反应均为非氧化还原反应,则甲的水溶液的pH比丙的水溶液的pH
②若丁为单质,下列关于物质乙、丙所含的同一元素的价态的推断,正确的是
a、乙一定更高 b、丙一定更高 c、乙和丙一样高 d、无法确定
(4)高温下,利用天然气生产合成气的过程涉及上述图示转化关系(生成的H2未标出),且丙能使石灰水变浑浊、“甲→乙”对应的反应为:CH4+H2O-CO+H2(未配平,条件略).
①当1mol甲与丁反应转化为乙时吸收206.1kJ的热量,1mol乙与丁反应转化为丙时放出41.2kJ的热量.则甲与丁直接转化为乙的热化学方程式为
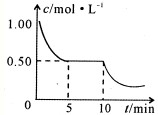
②将甲与丁混合于容积不变密闭容器中,甲将转化为乙,且反应过程中甲浓度变化情况如图所示.试推测:反应10min时,改变的外界条件可能是
③t℃时,乙转化为丙反应化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中乙、丁、丙和氢气的物质的量依次为0.5mol、8.5mol、2.0mol和2.0mol.此时反应正、逆反应速率的关系式是
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) D.无法判断.
查看习题详情和答案>>
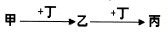
(1)若甲、丁分别为铁和氯气中的一种,则丙的酸性溶液露置于空气中将变质.变质过程所发生反应的离子方程式为
4Fe2++O2+4H+═4Fe3++2H2O
4Fe2++O2+4H+═4Fe3++2H2O
.(2)已知乙、丁均为空气中含量最多的两种单质,且由甲、丁和NaOH溶液构成的新型燃料电池放电时甲与丁作用转化为乙(同时生成一种对生命活动有重要意义的物质),负极反应式为
2NH3+6OH-═N2+6H2O+6e-
2NH3+6OH-═N2+6H2O+6e-
.(3)图示转化关系对应的反应既可以是非氧化还原反应,也可以是氧化还原反应.
①若丁为盐酸且反应均为非氧化还原反应,则甲的水溶液的pH比丙的水溶液的pH
大
大
(填“大”或“小”).②若丁为单质,下列关于物质乙、丙所含的同一元素的价态的推断,正确的是
d
d
.a、乙一定更高 b、丙一定更高 c、乙和丙一样高 d、无法确定
(4)高温下,利用天然气生产合成气的过程涉及上述图示转化关系(生成的H2未标出),且丙能使石灰水变浑浊、“甲→乙”对应的反应为:CH4+H2O-CO+H2(未配平,条件略).
①当1mol甲与丁反应转化为乙时吸收206.1kJ的热量,1mol乙与丁反应转化为丙时放出41.2kJ的热量.则甲与丁直接转化为乙的热化学方程式为
CH4(g)+2H2O=CO2(g)+4H2(g)△H=+164.9KJ/mol
CH4(g)+2H2O=CO2(g)+4H2(g)△H=+164.9KJ/mol
(丁均为气态).②将甲与丁混合于容积不变密闭容器中,甲将转化为乙,且反应过程中甲浓度变化情况如图所示.试推测:反应10min时,改变的外界条件可能是
降低温度
降低温度
.
③t℃时,乙转化为丙反应化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中乙、丁、丙和氢气的物质的量依次为0.5mol、8.5mol、2.0mol和2.0mol.此时反应正、逆反应速率的关系式是
a
a
(填代号).a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) D.无法判断.
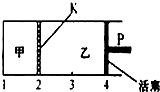 已知可逆反应:A(s)+2B(g)═C(g)+D(g)△H<0.在一定温度下将1mol A和2molB加入如图所示甲容器中,将2molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
已知可逆反应:A(s)+2B(g)═C(g)+D(g)△H<0.在一定温度下将1mol A和2molB加入如图所示甲容器中,将2molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )| A、保持乙中压强不变,升高温度,达到新的平衡后,乙中平均相对分子质量增大 | B、保持温度和乙中压强不变,向乙中再加入2 mol D,达到新平衡后,一定有c(B)乙>c(B)甲 | C、若该温度下反应的K=1,则甲中B和乙中C的转化率均为66.7% | D、保持温度和活塞位置不变,甲中再加入1 mol A和2mol B,达到新的平衡后,c(B)甲=2c(B)乙 |
 (2011?常州三模)已知可逆反应:A(s)+2B(g)?C(g)+D(g)△H<0.在一定温度下将1mol A和2molB加入如图所示甲容器中,将2molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )
(2011?常州三模)已知可逆反应:A(s)+2B(g)?C(g)+D(g)△H<0.在一定温度下将1mol A和2molB加入如图所示甲容器中,将2molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动).下列说法正确的是( )