摘要: 在2L密闭容器内.800℃时反应:2NO(g)+O2(g)2NO2随时间的变化如表: 时间(s) 0 1 2 3 4 5 n 0.020 0.01. 0.008 0.007 0.007 0.007 ⑴写出该反应的平衡常数表达式:K= . 已知:>.则改反应是 热反应. ⑵右图中表示NO2的变化的曲线是 . 用O2表示从0~2s内该反应的平均速率v= . ⑶能说明该反应已达到平衡状态的是 . a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v逆 (NO)=2v正 (O2) d.容器内密度保持不变 ⑷ 为使该反应的反应速率增大.且平衡向正反应方向移动的是 . a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
网址:http://m.1010jiajiao.com/timu3_id_48060[举报]
某温度(t℃)时,在2L密闭容器内发生反应:2A (g)+B(g)?2C(g)体系中n(A)随时间的变化如下表:
请回答:
(1)用A浓度变化表示从0~2s内该反应的平均速率v= mol/.
(2)能说明该反应已达到化学平衡状态的是 (填序号).
①容器内压强保持不变 ②A的物质的量保持不变
③容器内密度保持不变 ④消耗2mol A的同时,消耗1mol B
(3)温度升高,A的转化率减小,则该正反应是 (填“吸热”或“放热”)反应.
(4)若开始时充入B的物质的量是A的一半,则t℃时平衡常数K的数值是 . 查看习题详情和答案>>
| 时间/s | 1 | 2 | 3 | 4 | |
| n(A)/mol | 2.0 | 1.0 | 0.8 | 0.8 | 0.8 |
(1)用A浓度变化表示从0~2s内该反应的平均速率v= mol/.
(2)能说明该反应已达到化学平衡状态的是 (填序号).
①容器内压强保持不变 ②A的物质的量保持不变
③容器内密度保持不变 ④消耗2mol A的同时,消耗1mol B
(3)温度升高,A的转化率减小,则该正反应是 (填“吸热”或“放热”)反应.
(4)若开始时充入B的物质的量是A的一半,则t℃时平衡常数K的数值是 . 查看习题详情和答案>>
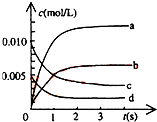 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
b
b
.(2)用O2表示从0~2s内该反应的平均速率v=
0.0015mol?L-1?S-1
0.0015mol?L-1?S-1
.(3)能说明该反应已达到平衡状态的是
be
be
.a、v (NO2)=2v (O2)
b、容器内压强保持不变
c、v逆(NO)=v正(O2)
d、容器内混合气体的密度保持不变
e、该容器内颜色保持不变.
2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索.“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂.
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂.但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体).
已知:N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-543kJ?mol-1;
H2(g)+
F2(g)═HF(g),△H=-269kJ?mol-1;H2(g)+
O2(g)═H2O(g),△H=-242kJ?mol-1
请写出肼和氟气反应的热化学方程式: .
Ⅱ.氧化剂二氧化氮可由NO和O2生成,已知在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2ΝΟ2(g)△H的体系中,n(NO)随时间的变化如表:
(1)已知:K800℃>K1000℃,则该反应的△H 0(填“大于”或“小于”),用O2表示从0~2s内该反应的平均速率为 .
(2)能说明该反应已达到平衡状态的是 .
a.容器内颜色保持不变 b. 2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 .
(4)在上述条件下,计算通入2mol NO和1mol O2的平衡常数K= .
(5)在上述条件下,若开始通入的是0.2mol NO2气体,达到化学平衡时,则NO2的转化率为 .
查看习题详情和答案>>
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂.但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体).
已知:N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-543kJ?mol-1;
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
请写出肼和氟气反应的热化学方程式:
Ⅱ.氧化剂二氧化氮可由NO和O2生成,已知在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2ΝΟ2(g)△H的体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
| n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(2)能说明该反应已达到平衡状态的是
a.容器内颜色保持不变 b. 2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有
(4)在上述条件下,计算通入2mol NO和1mol O2的平衡常数K=
(5)在上述条件下,若开始通入的是0.2mol NO2气体,达到化学平衡时,则NO2的转化率为
氮化硅(Si3N4)是一种新型陶瓷材料,800℃下,石英、焦炭和氮气通过以下反应可制得氮化硅.3SiO2(s)+6C(s)+2N2(g)
Si3N4(s)+6CO(g)
(1)该反应中的氧化产物是 .
(2)800℃下,该反应的平衡常数表达式K= .
(3)已知:该反应K800℃>K 850℃,则该反应是 反应.(填“放热”或“吸热”).
(4)一定温度下,在2L密闭容器内,充入一定量SiO2、C、N2进行上述反应,N2的物质的量随时间(t)的变化如下表:
从反应初到平衡时,CO的平均生成速率为v(CO)= mol/(L?min).
(5)若压缩(4)中的密闭体系,则上述平衡向 反应方向移动.(填“正”或“逆”).
(6)能使SiO2的转化率增大的措施是 .(填标号)
A.及时分离出CO气体 B.降低温度 C.增加C的初始量 D.使用适宜催化剂. 查看习题详情和答案>>
| ||
(1)该反应中的氧化产物是
(2)800℃下,该反应的平衡常数表达式K=
(3)已知:该反应K800℃>K 850℃,则该反应是
(4)一定温度下,在2L密闭容器内,充入一定量SiO2、C、N2进行上述反应,N2的物质的量随时间(t)的变化如下表:
| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(N2)/mol | 2.00 | 1.40 | 1.12 | 1.00 | 1.00 | 1.00 |
(5)若压缩(4)中的密闭体系,则上述平衡向
(6)能使SiO2的转化率增大的措施是
A.及时分离出CO气体 B.降低温度 C.增加C的初始量 D.使用适宜催化剂. 查看习题详情和答案>>