题目内容
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂.但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体).
已知:N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=-543kJ?mol-1;
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
请写出肼和氟气反应的热化学方程式:
Ⅱ.氧化剂二氧化氮可由NO和O2生成,已知在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2ΝΟ2(g)△H的体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
| n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(2)能说明该反应已达到平衡状态的是
a.容器内颜色保持不变 b. 2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有
(4)在上述条件下,计算通入2mol NO和1mol O2的平衡常数K=
(5)在上述条件下,若开始通入的是0.2mol NO2气体,达到化学平衡时,则NO2的转化率为
II.(1)根据温度越高,K越小,说明升高温度平衡逆移;根据氧气的浓度变化计算其反应速率;
(2)可逆反应达到平衡时,v正=V逆 (同种物质表示)或正逆速率之比等于化学计量数之比(不同物质表示),反应混合物各组分的物质的量、浓度、含量不再变化,以及由此衍生的一些量也不发生变化,由此进行判断;
(3)根据影响平衡的因素分析;
(4)根据温度不变,K不变,所以所以根据表格中数据计算即可;
(5)在上述条件下,若开始通入的是0.2mol NO2气体,若把NO2全部转化为NO和O2,恰好与原来的反应的初始量相同,则与原平衡为等效平衡,根据等效平衡原理分析.
| 1 |
| 2 |
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
利用盖斯定律可知①+②×4-③×2可得反应N2H4(g)+2F2(g)=N2(g)+4HF(g),
该反应的△H=(-543kJ?mol-1)+4×(-269kJ?mol-1)-2×(-242kJ?mol-1)=-1135kJ?mol-1,所以肼和氟气反应的热化学方程式:N2H4(g)+2F2(g)=N2(g)+4HF(g)△H=-1135kJ?mol-1;
故答案为:N2H4(g)+2F2(g)=N2(g)+4HF(g)△H=-1135kJ?mol-1;
II.(1)已知:K800℃>K1000℃,说明温度越高,K越小,说明升高温度平衡逆移,即正方向为放热反应;
0~2s内氧气的浓度变化为△c(O2)=
| 0.100-0.040 |
| 2 |
| △c |
| t |
| 0.030mol/L |
| 2s |
故答案为:小于;0.015 mol?L-1?s-1;
(2)a、随反应进行,反应混合气体中NO2浓度增大,气体颜色变深,当容器内颜色保持不变,说明反应到达平衡,故a错误;
b、当达到平衡状态时,v逆(NO)=2v正(O2),故b错误;
c、随反应进行,反应混合气体的总物质的量减少,压强减小,当压强不变即是平衡状态,故c正确;
d、混合气体的总质量不变,容器容积为定值,所以密度自始至终不变,不能说明达到平衡,故d错误;
故答案为:ac;
(3)已知2NO(g)+O2(g)?2ΝΟ2(g)△H<0,为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动,则应该通入氧气、增大压强;
故答案为:通入氧气、增大压强;
(4)反应的温度不变,则K不变,由表中数据可知:平衡时c(NO)=0.0025mol/L,c(O2)=0.00125mol/L,c(ΝΟ2)=
| (0.200-0.050)mol |
| 2L |
则K=
| c2(NO2) |
| c2(NO)?c(O2) |
| 0.0752 |
| 0.00252×0.00125 |
故答案为:720;
(5)在上述条件下,若开始通入的是0.2mol NO2气体,若把NO2全部转化为NO和O2,恰好与原来的反应的初始量相同,则与原平衡为等效平衡,原平衡中NO的转化率为
| 0.200-0.050 |
| 0.200 |
故答案为:25%.

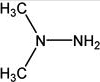
 嫦娥三号探测器已于2013年12月2日凌晨1:30分在四川省西昌卫星发射中心使用长征三号乙增强型运载火箭发射成功.火箭的一子级和二子级使用偏二甲肼和N2O4作为推进剂,反应式为(CH3)2NNH2+2N2O4═2CO2+4H2O+3N2,三子级则使用效能更高的液氢(H2)和液氧(O2).下列说法正确的是( )
嫦娥三号探测器已于2013年12月2日凌晨1:30分在四川省西昌卫星发射中心使用长征三号乙增强型运载火箭发射成功.火箭的一子级和二子级使用偏二甲肼和N2O4作为推进剂,反应式为(CH3)2NNH2+2N2O4═2CO2+4H2O+3N2,三子级则使用效能更高的液氢(H2)和液氧(O2).下列说法正确的是( )| A、N2O4在反应中被氧化 | B、(CH3)2NNH2具有还原性 | C、反应中1mol N2O4得到4mol e- | D、液氢与液氧的反应中,液氢与液氧的体积比为 2:1 |
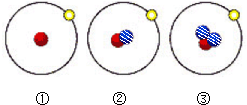 2013年12月2日“嫦娥三号”进行首次月球软着陆,它携带的核能电池又称放射性同位素发电装置.下列有关简单原子的原子结构①②③的叙述正确的是( )(其中
2013年12月2日“嫦娥三号”进行首次月球软着陆,它携带的核能电池又称放射性同位素发电装置.下列有关简单原子的原子结构①②③的叙述正确的是( )(其中 表示质子,
表示质子, 表示中子,
表示中子, 表示电子)
表示电子)| A、①②③都是由质子、中子、电子组成的 | B、①②③都为氢元素的一种核素 | C、①②③具有相同的质量数 | D、①②③是三种化学性质完全不同的粒子 |
2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
 H2(g)+
H2(g)+  F2(g)
= HF(g) △H = -269kJ·mol-1
F2(g)
= HF(g) △H = -269kJ·mol-1
H2(g)+  O2(g)
= H2O(g) △H = -242kJ·mol-1
O2(g)
= H2O(g) △H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g) 2NO2(g)
ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g)
ΔH 的体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.200 |
0.100 |
0.080 |
0.050 |
0.050 |
0.050 |
|
n(O2)(mol) |
0.100 |
0.050 |
0.040 |
0.025 |
0.025 |
0.025 |
(1) 已知:K800℃>K1000℃,则该反应的ΔH ______0(填“大于”或“小于”),用O2表示从0~2 s内该反应的平均速率为__________。
(2)能说明该反应已达到平衡状态的是________。
a.容器内颜色保持不变 b. 2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。