摘要: 在一定温度下.一定体积的密闭容器中有如下平衡: 已知H2和I2的起始浓度均为时.达平衡时HI的浓度为.若H2和I2的起始浓度均变为.则平衡时H2的浓度()是 A. 0.16 B. 0.08 C. 0.04 D. 0.02
网址:http://m.1010jiajiao.com/timu3_id_48014[举报]
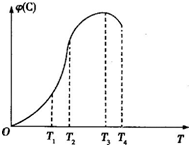 可逆反应A+B?2C,在不同温度下经过一定的时间,混合物C的体积分数与温度的关系如图所示:
可逆反应A+B?2C,在不同温度下经过一定的时间,混合物C的体积分数与温度的关系如图所示:(1)反应在
T3
T3
时达到化学平衡.(2)此反应的正反应为
放
放
热反应.(3)由T1向T2变化时,v(正)
>
>
v(逆)(填“>”、“<”或“=”).在一定温度下,固定体积为2L密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H<0,n(SO2)随时间的变化如表:
则下列说法正确的是( )
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
| A、当v(SO2)=v(SO3)时,说明该反应已达到平衡状态 |
| B、用O2表示0~4min内该反应的平均速率为0.005mol/(L?min) |
| C、若升高温度,则SO2的反应速率会变大,平衡常数K值会增大 |
| D、平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大 |
(1)写电离方程式:①H2SO4
(2)写出下列盐溶液的水解离子方程式:
①Fe(NO3)3
②NaF
③K2CO3
(3)在T℃下,将1mol N2和3mol H2的混合气体通入固定体积为2L的密闭容器内,起始压强为101KPa,经过30s达到平衡,测得平衡混合气体的平均相对分子质量为10.试求:
①此反应过程中N2的平均反应速率为
②H2的转化率为
③维持一定温度和压强不变,在起始体积为2L的体积可变的容器中充入1mol N2、3mol H2,达平衡时N2的转化率与上述平衡相等,则该平衡时,容器的体积为
(4)有可逆反应A(g)+B(g)?2C(g),在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.填写下列空白:
①反应在
②正反应为
③由T3向T4变化时,v正
查看习题详情和答案>>
H2SO4═2H++SO42-
H2SO4═2H++SO42-
;②NaHCO3NaHCO3=Na++HCO3-
NaHCO3=Na++HCO3-
;HCO3-?CO32-+H+
HCO3-?CO32-+H+
;(2)写出下列盐溶液的水解离子方程式:
①Fe(NO3)3
Fe3++3H2O?Fe(OH)3+3H+
Fe3++3H2O?Fe(OH)3+3H+
;②NaF
F-+H2O?HF+OH-
F-+H2O?HF+OH-
;③K2CO3
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
(以第一步为主)(3)在T℃下,将1mol N2和3mol H2的混合气体通入固定体积为2L的密闭容器内,起始压强为101KPa,经过30s达到平衡,测得平衡混合气体的平均相对分子质量为10.试求:
①此反应过程中N2的平均反应速率为
0.005mol?L-1?s-1
0.005mol?L-1?s-1
.②H2的转化率为
30%
30%
.③维持一定温度和压强不变,在起始体积为2L的体积可变的容器中充入1mol N2、3mol H2,达平衡时N2的转化率与上述平衡相等,则该平衡时,容器的体积为
1.7
1.7
L.
(4)有可逆反应A(g)+B(g)?2C(g),在不同温度下经过一定时间,混合物中C的体积分数与温度的关系如图所示.填写下列空白:
①反应在
T3
T3
温度下达到平衡.②正反应为
放热
放热
热反应(填“放”或“吸”).③由T3向T4变化时,v正
<
<
v逆(填“>”、“<”或“=”).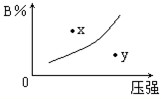 反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )