网址:http://m.1010jiajiao.com/timu3_id_47683[举报]
|
6.4 g铜与过量的硝酸(8 mol·L-1 60 mL)充分反应后,硝酸的还原产物有NO、NO2,反应后溶液中所含H+离子为n mol,此时溶液中所含NO-3的物质的量为 | |
A. |
0 .28 mol |
B. |
0 .31 mol |
C. |
(n+0 .2)mol |
D. |
(n+0 .4)mol |
现有下列物质:①NaCO3•10H2O晶体 ②铜 ③氯化氢 ④CO2 ⑤NaHSO4 固体 ⑥Ba(OH)2 固体 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩熔化的Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:(填编号)
| 分类标准 | 能导电的物质 | 电解质 | 非电解质 |
| 属于该类的物质 |
(2)上述物质中有物质之间可发生离子反应:H++OH-![]() H2O,写出一个该离子反应对应的化学方程式 。
H2O,写出一个该离子反应对应的化学方程式 。
(3)⑩在水中的电离方程式为 ,17.1g⑩溶于水配成250mL溶液, SO42-的物质的量浓度为 。
(4)区别⑦和⑨的方法是 ,将⑨滴加到⑦中至过量的实验现象是
(5)②与⑨发生反应的化学方程式为: 2KMnO4 + 16HCl ══ 2KCl+2MnCl2+5Cl2↑+ 8H2O
上述反应的离子方程式 ,还原产物是 (填化学式)。
体现的盐酸的性质有 , 标况下生成3.36LCl2,转移电子的数目约为 ,被还原的盐酸的物质的量为 。
(6)向⑧中通入③至恰好完全反应,则⑧的导电能力的变化为
(7)将⑥的溶液滴加到⑤的溶液中至恰好沉淀为止时的离子方程式为 。
(8)用① 配制450mL 0.1 mol/L Na2CO3溶液,请回答下列问题:
a应用托盘天平称取Na2CO3·10H2O晶体______g。
b配制Na2CO3溶液时需用的主要仪器有托盘天平、烧杯、药匙、________、________、________。
c实验中下列情况会使所配溶液浓度偏低的是________
A.加水时超过刻度线 B.洗涤液未移入容量瓶
C.容量瓶内壁附有水珠而未干燥 D.定容时俯视刻度线
查看习题详情和答案>>“氢能”将是未来最理想的新能源.
Ⅰ.实验测得,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则氢气燃烧的热化学方程式为________.(填序号)
A.
2H2(g)+O2(g)B.H2(g)+1/2O2(g)![]() H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
C.2H2+O2![]() 2H2O(l) ΔH=-571.6 kJ·mol-1
2H2O(l) ΔH=-571.6 kJ·mol-1
D.H2(g)+1/2O2(g)![]() H2O(g) ΔH=-285.8 kJ·mol-1
H2O(g) ΔH=-285.8 kJ·mol-1
Ⅱ
.某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤①CaBr2+H2O CaO+2HBr
CaO+2HBr
②2HBr+Hg HgBr2+H2
HgBr2+H2
③HgBr2+________ ________
________
④2HgO 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________.
根据“
绿色化学”的思想评估该方法制H2的主要缺点:________.Ⅲ
.利用核能把水分解制氢气,是目前正在研究的课题.下图是其中的一种流程,其中用了过量的碘.(提示:反应②的产物是O2、SO2和H2O)
完成下列
反应的化学方程式:反应①________;反应②________.
此法制取
氢气的最大优点是________.Ⅳ
.氢气通常用生产水煤气的方法制得.其中CO(g)+H2O(g)(1)若升高温度到950℃时,达到平衡时K________1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向________(填正反应或逆反应)方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________.
(3)在850℃时,若设x=5.0 mol和x=6.0 mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a________b(填“大于”、“小于”或“等于”).
Ⅴ
.氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和单质铜.(1)现有8克氧化铜被氢气还原后,得到红色固体6.8克,其中含单质铜与氧化亚铜的物质的量之比是________;
(2)若将6.8克上述混合物与足量的稀硫酸充分反应后过滤,可得到固体________g;
(3)若将6.8克上述混合物与一定量的浓硝酸充分反应,
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是________,其物质的量之比是________;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体23.68 g.经分析,原溶液中的Cu2+有20%残留在母液中.求所得晶体的化学式
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液.
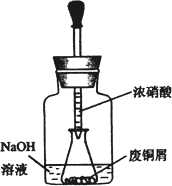
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品.
完成下列填空:
1.写出浓硝酸与铜反应的离子方程式.
2.上图装置中NaOH溶液的作用是________.反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有________(填写化学式).
3.步骤二中,水浴加热所需仪器有________、________(加热、夹持仪器、石棉网除外);洗涤的目的是________.
4.步骤二的滤液中可能含有CO32-,写出检验CO32-的方法.
5.影响产品产量的主要因素有________.
6.若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是________.
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2·nCuCO3表示。实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
Ⅰ.废铜屑制硝酸铜
方案1:将铜屑在空气中充分灼烧,残留固体溶于稀硝酸;
方案2:如图1(夹持仪器已省略)。将浓硝酸缓慢加到废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
方案3:将方案2中浓硝酸换成稀硝酸,其他不变。
Ⅱ.碱式碳酸铜的制备
①向大试管中加入碳酸钠溶液和硝酸铜溶液
②水浴加热至70 ℃左右
③用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡、静置、过滤
④用热水洗涤、烘干,得到碱式碳酸铜产品
请回答下列问题:
(1)按方案1实验,必须选择的下列仪器有________(填序号)。
(2)图2中能分别替代图1中B和C装置的是________(填装置序号)。
(3)已知:NO+NO2+2NaOH===2NaNO2+H2O;2NO2+2NaOH===NaNO3+NaNO2+H2O,NO不能单独与NaOH溶液反应,实验结束时,如何操作才能使装置中的有毒气体被NaOH溶液完全吸收?__________________________。
(4)步骤④中洗涤的目的是______________________________________。
(5)步骤③过滤后的滤液中含有CO32—,检验CO32—的方法是_________________________________________________________。
(6)测定碱式碳酸铜组成的方法主要有两种:
方法1 灼烧法:取34.6 g纯净物mCu(OH)2·nCuCO3,在硬质试管里灼烧,将气体产物依次通入足量的浓硫酸、足量的碱石灰中,完全吸收后浓硫酸净增1.8 g,碱石灰净增8.8 g。
方法2 还原法:在氢气中加强热,测反应前后固体的质量。
①利用上述数据推算碱式碳酸铜的化学式_____________________。
②配平化学方程式:mCu(OH)2·nCuCO3+________H2 ________Cu+________CO2↑+________H2O
________Cu+________CO2↑+________H2O