网址:http://m.1010jiajiao.com/timu3_id_47603[举报]

已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:回答下列问题:
(1)滤渣的主要成分为
(2)“趁热过滤”的原因是
(3)若在实验室进行“趁热过滤”,可采取的措施是
(4)若“母液”循环使用,可能出现的问题及其原因是
(5)已知:
Na2CO3?10H2O(s)=Na2CO3(s)+10H2O(g)△H1=+532.36kJ?mol-1;Na2CO3?10H2O(s)=Na2CO3?H2O(s)+9H2O(g)△H2=+473.63kJ?mol-1,写出Na2CO3?H2O脱水反应的热化学方程式

已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:

回答下列问题:
(1)滤渣的主要成分为________________。
(2)“趁热过滤”的原因是________________________________________。
(3)若在实验室进行“趁热过滤”,可采取的措施是_______________________(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是_____________________________。
(5)已知:Na2CO3·10H2O(s)![]() Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)![]() Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式______________________________。
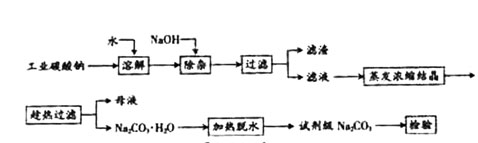
查看习题详情和答案>>碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:

已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
【小题1】(1)滤渣的主要成分为 。
【小题2】(2)“趁热过滤”的原因是 。
【小题3】(3)若在实验室进行“趁热过滤”,可采取的措施是 (写出1种)。
【小题4】(4)若“母液”循环使用,可能出现的问题及其原因是 。
【小题5】(5)已知:
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1=" +532.36" kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH1=" +473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。
(08年广东卷)碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(钝度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO![]() 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:

已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
 回答下列问题:
回答下列问题:
(1)滤渣的主要成分为 。
(2)“趁热过滤”的原因是 。
(3)若在实验室进行“趁热过滤”,可采取的措施是 (写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是 。
(5)已知:
Na2CO3?10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ?mol-1
Na2CO3?10H2O(s)=Na2CO3?H2O(s)+9H2O(g) ΔH1=+473.63 kJ?mol-1
写出Na2CO3?H2O脱水反应的热化学方程式 。
查看习题详情和答案>>碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO![]() 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:
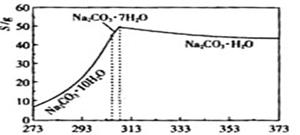 已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
(1)滤渣的主要成分为 。
(2)“趁热过滤”的原因是 。
(3)若在实验室进行“趁热过滤”,可采取的措施是 (写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是 。
(5)已知:
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1= +532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H??2O(g) ΔH1= +473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。
查看习题详情和答案>>