题目内容
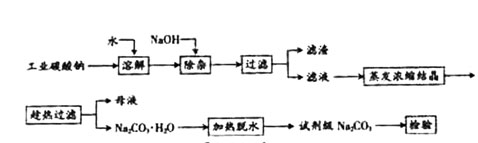
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO![]() 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:
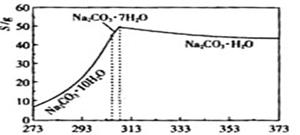 已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
回答下列问题:
(1)滤渣的主要成分为 。
(2)“趁热过滤”的原因是 。
(3)若在实验室进行“趁热过滤”,可采取的措施是 (写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是 。
(5)已知:
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1= +532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H??2O(g) ΔH1= +473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式 。
【小题1】(1)滤渣的主要成分为Mg(OH)2、Fe(OH)3、CaCO3。
【小题2】(2)“趁热过滤”的原因是使析出的晶体为Na2CO3·H2O,防止因温度过低而析出Na2CO3·10H2O晶体,令后续的加热脱水耗时长。
【小题3】(3)若在实验室进行“趁热过滤”,可采取的措施是用已预热的布氏漏斗趁热抽滤。
【小题4】(4)若“母液”循环使用,可能出现的问题及其原因是问题:溶解时有大量沉淀生成,使Na2CO3损耗且产物Na2CO3混有杂质;原因:“母液”中,含有的离子有Ca2+,Na+,Cl-,SO42-,OH-,CO32-,当多次循环后,使用离子浓度不断增大,溶解时会生成CaSO4,Ca(OH)2,CaCO3等沉淀。
【小题5】(5)写出Na2CO3·H2O脱水反应的热化学方程式
Na2CO3·H2O(S)==== Na2CO3(s) + H2O(g);H= +58.73kJ/mol
解析:
【小题1】(1)因工业碳酸钠中含有Mg2+,Fe3+,Ca2+,所以“除杂”中加入过量的NaOH溶液,可生成Mg(OH)2、Fe(OH)3、Ca(OH)2沉淀。
【小题2】(2)观察坐标图,温度减少至313K时发生突变,溶解度迅速减少,弱不趁热过滤将析出晶体。
【小题3】(3)思路方向:1.减少过滤的时间 2.保持过滤时的温度。
【小题4】(4)思路:分析“母液”中存在的离子,若参与循环,将使离子浓度增大,对工业生产中哪个环节有所影响。
【小题5】(5)通过观察两个热化学方程式,可将两式相减,从而得到Na2CO3·H2O(s)==== Na2CO3(s)+ H2O(g)。






 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:

 等杂质,提纯工艺路线如下:已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示。
等杂质,提纯工艺路线如下:已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示。