网址:http://m.1010jiajiao.com/timu3_id_4749[举报]
(1)兴趣小组的同学想探究钢铁锈蚀的条件,他将一个干净的铁钉放入试管中(如图一),定期观察并记录现象.图一中最先锈蚀的部位
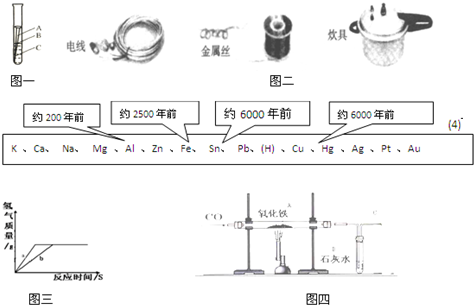
(2)根据图二的应用实例,试说出金属具有的一点物理性质
(3)铝的活动性比铁强,但铝在空气中却表现出良好的抗腐蚀性,原因是
(4)下表中不同的金属被开发、利用的年代不同,决定这一先后顺序的关键因素是
A.金属的活动性 B.金属的导电性
C.金属的延展性 D.地壳中金属元素的含量
(5)用质量相等的镁粉和铝粉,分别与溶质质量分数相同、等质量的稀盐酸充分反应,产生氢气的质量和反应所用时间的关系如图三所示.则下列说法中正确的是
A.曲线a、b分别表示镁、铝的反应情况 B.盐酸均反应完,镁恰好完全反应,铝剩余
C.盐酸均反应完,镁、铝也恰好完全反应 D.镁、铝都反应完,盐酸有剩余
(6)联想到工业上用铁矿石冶炼铁,他们在实验室用CO还原氧化铁,实验如图四所示
①A、B处发生的现象分别是A
②为了防止溶液倒吸,本实验停止加热前是否要先断开A和B的连接处?
| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯和药品的质量/g | 166.5 | 166.3 | 166.1 | 166.1 |
记录如表.求:①反应中产生氢气
(12分)铁及其化合物在生活生产中有重要的应用。请回答下列问题:
(1)铁制品在空气中易锈蚀,其实质是铁与空气中的氧气、 等接触后发生化学反应的过程。
(2)在盛有氧气的集气瓶中点燃细铁丝发生剧烈燃烧的化学方程式是 。为防止集气瓶破裂,常采取的措施是 。
(3)把铁粉和铜粉的混合物放入硝酸银溶液中,充分反应后,过滤,为确定滤渣和滤液的成分,甲同学向滤渣中滴加稀盐酸,无气泡产生; 乙同学向滤液中滴加稀盐酸,产生白色沉淀。根据两同学实验的现象,分析下列结论不正确的是 (填写字母序号)。
A.滤渣中只含银 B.滤渣中一定含有银,可能含有铜
C.滤液中一定有Ag+ 、Fe2+ 和Cu2+ D.滤液中只含Ag+ 和Fe2+,不含Cu2+
【探究】废旧金属的回收利用。
废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),生产动物饲料添加剂硫酸亚铁的工艺之一如下图所示:
(4)在反应器中发生反应的化学方程式有:
Fe + H2SO4 =FeSO4 +H2↑、 、 Fe2(SO4)3 + Fe = 3FeSO4。
(5)滤液M中肯定含有的溶质的化学式是 ;
(6)在化学反应中,凡是有元素化合价变化的反应属于氧化还原反应。下列反应类型肯定属于氧化还原反应的是 (填字母编号);
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
(7)取表面含有氧化镁的镁条(无其它杂质)2.5g,加入到足量的20.0g的稀硫酸中,充分反应后,所得溶液的质量为22.3g。求:该镁条中单质镁的质量分数。
(1)铁制品在空气中易锈蚀,其实质是铁与空气中的氧气、 等接触后发生化学反应的过程。
(2)在盛有氧气的集气瓶中点燃细铁丝发生剧烈燃烧的化学方程式是 。为防止集气瓶破裂,常采取的措施是 。
(3)把铁粉和铜粉的混合物放入硝酸银溶液中,充分反应后,过滤,为确定滤渣和滤液的成分,甲同学向滤渣中滴加稀盐酸,无气泡产生; 乙同学向滤液中滴加稀盐酸,产生白色沉淀。根据两同学实验的现象,分析下列结论不正确的是 (填写字母序号)。
A.滤渣中只含银 B.滤渣中一定含有银,可能含有铜
C.滤液中一定有Ag+ 、Fe2+ 和Cu2+ D.滤液中只含Ag+ 和Fe2+,不含Cu2+
【探究】废旧金属的回收利用。
废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),生产动物饲料添加剂硫酸亚铁的工艺之一如下图所示:

(4)在反应器中发生反应的化学方程式有:
Fe + H2SO4 =FeSO4 +H2↑、 、 Fe2(SO4)3 + Fe = 3FeSO4。
(5)滤液M中肯定含有的溶质的化学式是 ;
(6)在化学反应中,凡是有元素化合价变化的反应属于氧化还原反应。下列反应类型肯定属于氧化还原反应的是 (填字母编号);
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
(7)取表面含有氧化镁的镁条(无其它杂质)2.5g,加入到足量的20.0g的稀硫酸中,充分反应后,所得溶液的质量为22.3g。求:该镁条中单质镁的质量分数。
铬(Cr)是一种重要的金属材料,它具有良好的金属光泽和抗腐蚀性,常用来镀在其他金属的表面上,铜、铬、锰、镍组成合金可以制成各种性能的不锈钢。某校化学研究小组对Cr(铬)、Al、Cu的金属的活动性顺序进行探究,过程如下:
(1)[作出假设]对三种金属的活动性顺序提出三种可能的假设是:
① ②
② ③
③
[设计实验]同温下,取大小相同的这三种金属薄片,分别投入等体积等浓度的足量稀盐酸中,观察现象,记录以下:
| 金属 | Cr | Al | Cu |
| 与盐酸反应现 | 气泡产生缓慢,金属逐渐溶解 | 气泡产生激烈,金属迅速溶解 | 无气泡产生,金属无变化 |
[控制实验条件]三种金属加入盐酸前都先用纱布将其表面擦光亮,其目的是 。
A.除去氧化膜,利于直接反应; B.使表面光亮,易观察现象;
C.使金属温度相同,易反应。
[得出结论]原假设中正确的是 (选填假设中①、②,③)。写出铬(铬
与盐酸反应后显+2价)与盐酸反应的化学方程式 。
[结论应用](1)根据探究结果,请你预测铬与硫酸铜溶液 (填“能”或“不
能”)反应,理由是 。
(2)铝的化学性质比较活泼,在空气中比铁更易被氧化,但铝制品比铁制品更耐用,
是因为铝制品表面有一层致密的氧化铝保护膜,阻止铝进一步被氧化。食醋不宜
用铝制品盛放,其原因是_______ 。
查看习题详情和答案>>