题目内容
(12分)铁及其化合物在生活生产中有重要的应用。请回答下列问题:
(1)铁制品在空气中易锈蚀,其实质是铁与空气中的氧气、 等接触后发生化学反应的过程。
(2)在盛有氧气的集气瓶中点燃细铁丝发生剧烈燃烧的化学方程式是 。为防止集气瓶破裂,常采取的措施是 。
(3)把铁粉和铜粉的混合物放入硝酸银溶液中,充分反应后,过滤,为确定滤渣和滤液的成分,甲同学向滤渣中滴加稀盐酸,无气泡产生; 乙同学向滤液中滴加稀盐酸,产生白色沉淀。根据两同学实验的现象,分析下列结论不正确的是 (填写字母序号)。
A.滤渣中只含银 B.滤渣中一定含有银,可能含有铜
C.滤液中一定有Ag+ 、Fe2+ 和Cu2+ D.滤液中只含Ag+ 和Fe2+,不含Cu2+
【探究】废旧金属的回收利用。
废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),生产动物饲料添加剂硫酸亚铁的工艺之一如下图所示:

(4)在反应器中发生反应的化学方程式有:
Fe + H2SO4 =FeSO4 +H2↑、 、 Fe2(SO4)3 + Fe = 3FeSO4。
(5)滤液M中肯定含有的溶质的化学式是 ;
(6)在化学反应中,凡是有元素化合价变化的反应属于氧化还原反应。下列反应类型肯定属于氧化还原反应的是 (填字母编号);
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
(7)取表面含有氧化镁的镁条(无其它杂质)2.5g,加入到足量的20.0g的稀硫酸中,充分反应后,所得溶液的质量为22.3g。求:该镁条中单质镁的质量分数。
(1)铁制品在空气中易锈蚀,其实质是铁与空气中的氧气、 等接触后发生化学反应的过程。
(2)在盛有氧气的集气瓶中点燃细铁丝发生剧烈燃烧的化学方程式是 。为防止集气瓶破裂,常采取的措施是 。
(3)把铁粉和铜粉的混合物放入硝酸银溶液中,充分反应后,过滤,为确定滤渣和滤液的成分,甲同学向滤渣中滴加稀盐酸,无气泡产生; 乙同学向滤液中滴加稀盐酸,产生白色沉淀。根据两同学实验的现象,分析下列结论不正确的是 (填写字母序号)。
A.滤渣中只含银 B.滤渣中一定含有银,可能含有铜
C.滤液中一定有Ag+ 、Fe2+ 和Cu2+ D.滤液中只含Ag+ 和Fe2+,不含Cu2+
【探究】废旧金属的回收利用。
废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),生产动物饲料添加剂硫酸亚铁的工艺之一如下图所示:

(4)在反应器中发生反应的化学方程式有:
Fe + H2SO4 =FeSO4 +H2↑、 、 Fe2(SO4)3 + Fe = 3FeSO4。
(5)滤液M中肯定含有的溶质的化学式是 ;
(6)在化学反应中,凡是有元素化合价变化的反应属于氧化还原反应。下列反应类型肯定属于氧化还原反应的是 (填字母编号);
A.化合反应 B.置换反应 C.分解反应 D.复分解反应
(7)取表面含有氧化镁的镁条(无其它杂质)2.5g,加入到足量的20.0g的稀硫酸中,充分反应后,所得溶液的质量为22.3g。求:该镁条中单质镁的质量分数。
(1)水(或水蒸气或H2O)(2)3Fe + 2O2点燃 Fe3O4 ;在集气瓶底放少量水(或沙子)(3)BD;(4)Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O(5)FeSO4、H2SO4;(6)B;(7)96%
试题分析:(1)铁制品在空气中易锈蚀,其实质是铁与空气中的氧气、水等接触后发生化学反应的过程。(2)在盛有氧气的集气瓶中点燃细铁丝发生剧烈燃烧的化学方程式是3Fe + 2O2点燃 Fe3O4 ;为防止集气瓶破裂,常采取的措施是在集气瓶底放少量水(或沙子);(3)把铁粉和铜粉的混合物放入硝酸银溶液中,充分反应后,过滤,为确定滤渣和滤液的成分,甲同学向滤渣中滴加稀盐酸,无气泡产生,根据质量守恒定律,说明滤渣中没有铁剩余,乙同学向滤液中滴加稀盐酸,产生白色沉淀,说明滤液中含有银离子,所以滤渣中只含有银,滤液中含有硝酸银、硝酸铜和硝酸铁;(4)在反应器中发生反应的化学方程式还有:Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O;(5)滤液M中肯定含有的溶质为生成的硫酸亚铁和剩余的硫酸,故的化学式是FeSO4、H2SO4;(6)在化学反应中,凡是有元素化合价变化的反应属于氧化还原反应。根据反应类型的特点,知下列反应类型肯定属于氧化还原反应的是置换反应。
(7)(3分)[解]设: 2.5g镁条样品中单质镁的质量为X
反应产生的氢气质量:2.5g + 20.0g - 22.3g = 0.2g (0.5分)
Mg+H2SO4 = MgSO4+H2↑
24 2
X 0.2g
24/2 = X/0.2g X = 2.4g (1分)
该镁条中单质镁的质量分数 =" 2.4g" / 2.5g X 100% = 96% (1分)
答:该镁条中单质镁的质量分数为96%。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
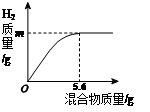
 SiO2+Ti,制取钛,该反应中的氧化剂是
SiO2+Ti,制取钛,该反应中的氧化剂是