摘要:解:AgNO3 + NaCl = AgCl↓+ Na NO3 n(AgNO3) = 0.100 mol·L-1×0.02 L = 0.002 mol m = 0.002 mol×58.5 g·mol-1 = 0.117 g V容器 = 13:ⅠA.物理变化.585t.NaOH+SO3==NaHSO3 NaHSO3+HCl==NaCL+H2O+SO2 ↑.CD 14.答案(1)根据题意 n(HCl) = 12 mol/L×0.2 L = 2.4 mol n(MnO2) = 17.4 g÷87 g/mol = 0.2 mol MnO2 + 4 HCl(浓) △ MnCl2 + Cl2↑+ 2H2O n(MnO2)∶n(HCl) = 2.4 mol∶0.2 mol = 12∶1 > 4∶1 所以浓HCl过量.应根据MnO2计算. 根据制备氯气的化学方程式 n(Cl\2) = n(MnO2) = 0.2 mol 又因为:2Cl2 + 2Ca(OH)2 = Ca(ClO)2 + CaCl2 + 2H2O n[Ca(ClO)2] = 1/2 n(Cl2) = 1/2×0.2 mol = 0.1 mol m[Ca(ClO)2] = 143 g/mol × 0.1 mol = 14.3 g (2)①随着反应进行.温度升高.会产生副产物Ca(ClO3)2, 6Cl2 + 6Ca(OH)2 △ 5CaCl2 + Ca(ClO3)2 + 6H2O ②Cl2未与石灰乳完全反应.残余Cl2被NaOH溶液吸收 Cl2 + 2NaOH = NaCl + NaClO + H2O
网址:http://m.1010jiajiao.com/timu3_id_47362[举报]
下图是一个电化学过程的示意图。
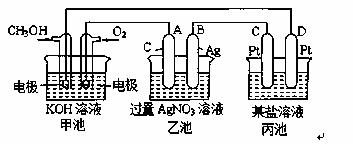
请回答下列问题:
(1)图中甲池的名称 (填“原电池”“电
解池”或“电镀池”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)乙池中反应的化学方程式为 ,
当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积为 L(标准状况下),此时丙池中 电极(填“C”或“D”)析出1.6g某金属,则丙池的某盐溶液可能是 (填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
(4)写出A和B的电极的电极反应式: , 。
查看习题详情和答案>>用类推的方法可能会得出错误结论,因此推出的结论要经过实践的检验才能确定其正确与否.下列类推结论中正确的是( )
| A、Na失火不能用CO2灭火,K失火不能用CO2灭火 | B、工业上电解熔融MgCl2制取金属镁,也用电解熔解AlCl3的方法制取金属铝 | C、Al与S直接化合可以得到Al2S3,Fe与S直接化合也可以得到Fe2S3 | D、Fe3O4可以写成FeO?Fe2O3,Pb3O4也可写成PbO?Pb2O3 |
(2011?上海)某无色溶液含有Na+、Fe3+、Cl-、SO42-中的2种离子,分别取该溶液进行了下列实验:根据上述实验,可以确定溶液中一定存在的离子是( )
(1)向溶液中滴加用硝酸酸化的AgNO3溶液,有白色沉淀产生;
(2)向溶液中滴加Ba(NO3)2溶液,没有任何现象.
(1)向溶液中滴加用硝酸酸化的AgNO3溶液,有白色沉淀产生;
(2)向溶液中滴加Ba(NO3)2溶液,没有任何现象.
查看习题详情和答案>>
(2012?保定一模)大气中硫、氮的氧化物是形成酸雨的主要物质.某地酸雨中可能含有下列离子:Na+、Ba2+、NH4+、Al3+、Cl-、SO32-、SO42-、NO3-等.某研究小组取该地一定量的酸雨,浓缩后将所得澄清试液分成3份,进行如下实验:
请回答下列问题:
(1)根据实验结果判断该酸雨中肯定不存在的离子是
(2)写出试液中滴加淀粉KI溶液所发生反应的离子方程式:
(3)设计实验方案,检验该试液中是否存在Cl-:
(4)该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是
(5)在0.5L密闭容器内加入NO2和SO2,为了测定在某种催化剂作用下反应:NO2(g)+SO2(g)?NO(g)+SO3(g)的反应速率,在t0C用气体传感器测得不同时间的NO2和SO2浓度如表(均不考虑温度变化对催化剂催化效率的影响):
①前2s内NO的平均反应速率v(NO)=
②t℃该反应的化学平衡常数K=
查看习题详情和答案>>
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸盐化的BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加溶液,加热,加入的氢氧化钠溶液体积(V)与生成的沉淀、产生的气体关系(n)如右图. | 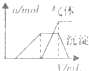 |
(1)根据实验结果判断该酸雨中肯定不存在的离子是
SO32-、Ba2+
SO32-、Ba2+
.(2)写出试液中滴加淀粉KI溶液所发生反应的离子方程式:
6I-+2NO3-+8H+=3I2+2NO↑+4H2O
6I-+2NO3-+8H+=3I2+2NO↑+4H2O
.(3)设计实验方案,检验该试液中是否存在Cl-:
取少量试液,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-
取少量试液,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-
(4)该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,再慢慢通入O2,发生化学反应后,再喷洒适量蒸馏水即得硫酸型酸雨,则NO在上述反应中的作用是
催化剂
催化剂
.(5)在0.5L密闭容器内加入NO2和SO2,为了测定在某种催化剂作用下反应:NO2(g)+SO2(g)?NO(g)+SO3(g)的反应速率,在t0C用气体传感器测得不同时间的NO2和SO2浓度如表(均不考虑温度变化对催化剂催化效率的影响):
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO2)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(SO2)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
3.75×10-4mol?L-1?s-1
3.75×10-4mol?L-1?s-1
.②t℃该反应的化学平衡常数K=
3
3
.