题目内容
下图是一个电化学过程的示意图。
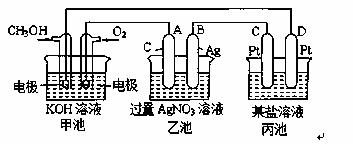
请回答下列问题:
(1)图中甲池的名称 (填“原电池”“电
解池”或“电镀池”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)乙池中反应的化学方程式为 ,
当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积为 L(标准状况下),此时丙池中 电极(填“C”或“D”)析出1.6g某金属,则丙池的某盐溶液可能是 (填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
(4)写出A和B的电极的电极反应式: , 。
(1) __原电池 ___
(2) CH3OH+8OH――6e-=CO32-+6H2O
(3)4AgNO3+2H2O![]() 4Ag+O2↑+4HNO3 ,0.28, D , BD
4Ag+O2↑+4HNO3 ,0.28, D , BD
(4) 4OH- -4e-=O2+2H2O , Ag++e-=Ag

练习册系列答案
相关题目

 为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH
为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。下图是一个电化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH 2K2CO3+6H2O
2K2CO3+6H2O
 _________L(标准状况下)。
_________L(标准状况下)。