网址:http://m.1010jiajiao.com/timu3_id_46734[举报]
阿伏加德罗常数的测定有多种方法,其中电解法是常用的方法.请回答下列有关问题:
现有同样浓度的![]() 等溶液.若实验过程中不考虑电极上的析出物与电解后的溶液之间的反应,则你认为选用哪一种溶液作为电解液,使得实验既简便、测定结果误差又小:________.
等溶液.若实验过程中不考虑电极上的析出物与电解后的溶液之间的反应,则你认为选用哪一种溶液作为电解液,使得实验既简便、测定结果误差又小:________.
(1)方法如下:用两块铜片做阴极和阳极,以硫酸铜溶液为电解质进行电解。两极反应式为:
阴极:________________,阳极:_______________;若电流强度为I(A),时间为t(s),在阴极上铜片的质量增加m(g),铜的摩尔质量为63.5g·mol-1,已知一个1价离子所带电量(即1个电子的电荷)是1.60×10-19C,则可求得阿佛加德罗常数为:(不用化简) NA=_______________
实验步骤:连好线路。取两块纯的紫铜片(3×5cm2)当作阴、阳极。在烧杯中加入CuSO4溶液(每1L溶液含125g硫酸铜和2.5mL浓H2SO4)。阴极和阳极的2/3浸没在CuSO4溶液中,电极之间的距离约为
1.5cm,控制直流电压为10V,电阻为90~100Ω。接通电路,再调节电阻使电流约为100mA。调好电流强度后,断开电路,取下电极,将两块铜片冲洗,擦干后,用“零”号砂纸擦去表面氧化物,然后用去离子水洗净,并在一块铜片上滴几滴酒精,晾干后,在分析天平上称出其质量为13.4400g,这块铜片作为阴极。另一块铜片作阳极。重新装好电极后,接通线路,同时开动秒表,并准确记录电流强度,在电解过程中,随时调节电阻维持电流为100mA。通电1h,断开电路,取下阴、阳极。先用去离子水漂洗,再在上面滴几滴酒精,晾干后在天平上称出阴极质量为13.5590g。
(2)根据以上所测数据、计算阿佛加德罗常数为:_______________。(保留三位有效数字)
回答以下问题:
(3)电解完成后,取下电极,用去离子水漂洗的目的是:_______________,如果不漂洗,最后的结果将偏_______(高、低、无影响);
(4)电极漂洗后在上面滴几滴酒精的目的是:_______________;
(5)电解过程中,为什么要维持电流恒定?_______________;
(6)电解后水洗,若未完全晾干就称量,结果将偏___________(高、低、无影响)。
[s1] 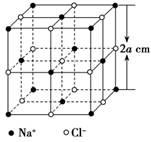 某同学甲欲测定阿伏加德罗常数,他通过查阅资料知:①晶体中重复出现的最小结构单元叫做晶胞,②X射线测得NaCl晶体中的晶胞如图所示,8a3 cm3的晶胞中含有4个Na+和4个Cl-。借鉴一定物质的量浓度溶液配制的思想,他设计了如下步骤来测定阿伏加德罗常数,请回答下列问题。
某同学甲欲测定阿伏加德罗常数,他通过查阅资料知:①晶体中重复出现的最小结构单元叫做晶胞,②X射线测得NaCl晶体中的晶胞如图所示,8a3 cm3的晶胞中含有4个Na+和4个Cl-。借鉴一定物质的量浓度溶液配制的思想,他设计了如下步骤来测定阿伏加德罗常数,请回答下列问题。
a.将固体NaCl研细并干燥,准确称取m g NaCl晶体装入定容仪器A中。
b.用仪器B向A中滴加苯,不断振荡,继续加苯至刻度线
c.重复上述步骤2~3次,计算出m g NaCl的体积平均为V cm3。
(1)步骤a中A仪器最好使用 (填序号)。
A.量筒 B.烧杯
C.容量瓶 D.试管
(2)步骤b中仪器B为 (填“酸式”或“碱式”)滴定管,因为 。
(3)该实验不能用水代替苯,原因是 。
(4)该方法测出的阿伏加德罗常数的表达式为 。
(5)某同学乙受甲的启发,欲用同样的方法使用固体碘来测定,能否成功? 。
[s1]14.
查看习题详情和答案>> [s1] 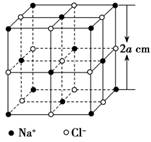 某同学甲欲测定阿伏加德罗常数,他通过查阅资料知:①晶体中重复出现的最小结构单元叫做晶胞,②X射线测得NaCl晶体中的晶胞如图所示,8a3 cm3的晶胞中含有4个Na+和4个Cl-。借鉴一定物质的量浓度溶液配制的思想,他设计了如下步骤来测定阿伏加德罗常数,请回答下列问题。
某同学甲欲测定阿伏加德罗常数,他通过查阅资料知:①晶体中重复出现的最小结构单元叫做晶胞,②X射线测得NaCl晶体中的晶胞如图所示,8a3 cm3的晶胞中含有4个Na+和4个Cl-。借鉴一定物质的量浓度溶液配制的思想,他设计了如下步骤来测定阿伏加德罗常数,请回答下列问题。
a.将固体NaCl研细并干燥,准确称取m g NaCl晶体装入定容仪器A中。
b.用仪器B向A中滴加苯,不断振荡,继续加苯至刻度线
c.重复上述步骤2~3次,计算出m g NaCl的体积平均为V cm3。
(1)步骤a中A仪器最好使用 (填序号)。
A.量筒 B.烧杯
C.容量瓶 D.试管
(2)步骤b中仪器B为 (填“酸式”或“碱式”)滴定管,因为 。
(3)该实验不能用水代替苯,原因是 。
(4)该方法测出的阿伏加德罗常数的表达式为 。
(5)某同学乙受甲的启发,欲用同样的方法使用固体碘来测定,能否成功? 。
[s1]14.
查看习题详情和答案>> 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定的精确度也越来越高.现有一种简单可行的测定方法,其具体操作步骤如下:
随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定的精确度也越来越高.现有一种简单可行的测定方法,其具体操作步骤如下:①用分析天平称取研细干燥的NaCl固体mg于体积为V1毫升的定容容器A中;
②用滴定管向定容容器A中加入苯,并不断振荡,加苯到定容容器A的刻度线时所加入苯的体积为V2毫升;根据以上操作回答以下问题:
(1)定容容器A最好用
(2)滴定管是用酸式滴定管还是用碱式滴定管?
(3)能否用水代替苯?
(4)测定离子化合物中离子间的间隔的方法是用X-射线衍射法,已知X-射线衍射仪测出的NaCl晶体中相邻Na+和Cl-的核间距为acm.则利用上述方法测得的阿伏加德罗常数的数学表达式为:NA=
| 58.5×(V1-V2) |
| 2ma3 |
| 58.5×(V1-V2) |
| 2ma3 |
(5)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分比为: