题目内容
 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定的精确度也越来越高.现有一种简单可行的测定方法,其具体操作步骤如下:
随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定的精确度也越来越高.现有一种简单可行的测定方法,其具体操作步骤如下:①用分析天平称取研细干燥的NaCl固体mg于体积为V1毫升的定容容器A中;
②用滴定管向定容容器A中加入苯,并不断振荡,加苯到定容容器A的刻度线时所加入苯的体积为V2毫升;根据以上操作回答以下问题:
(1)定容容器A最好用
容量瓶
容量瓶
(填实验仪器名称);(2)滴定管是用酸式滴定管还是用碱式滴定管?
酸式滴定管
酸式滴定管
,为什么?因苯能腐蚀碱式滴定管的橡皮管
因苯能腐蚀碱式滴定管的橡皮管
;(3)能否用水代替苯?
不能
不能
,为什么?因NaCl溶于水,无法测出NaCl的体积
因NaCl溶于水,无法测出NaCl的体积
;(4)测定离子化合物中离子间的间隔的方法是用X-射线衍射法,已知X-射线衍射仪测出的NaCl晶体中相邻Na+和Cl-的核间距为acm.则利用上述方法测得的阿伏加德罗常数的数学表达式为:NA=
NA=
| 58.5×(V1-V2) |
| 2ma3 |
NA=
;| 58.5×(V1-V2) |
| 2ma3 |
(5)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因,假设某纳米颗粒的大小和形状恰好等于氯化钠晶胞的大小和形状,则这种纳米颗粒的表面原子占总原子数的百分比为:
97%
97%
.分析:(1)定容仪器为容量瓶;
(2)苯应用酸式滴定管盛装,因苯能腐蚀碱式滴定管的橡皮管;
(3)要测量mgNaCl固体的体积不能用水,因NaCl溶于水,无法测出NaCl的体积;
(4)根据NaCl的密度和晶体的体积计算出一个NaCl晶胞的质量,根据1molNaCl的质量、摩尔质量和阿伏加德罗常数的关系计算阿伏加德罗常数;
(5)根据晶胞的结构计算纳米颗粒的表面原子占总原子数的百分比.
(2)苯应用酸式滴定管盛装,因苯能腐蚀碱式滴定管的橡皮管;
(3)要测量mgNaCl固体的体积不能用水,因NaCl溶于水,无法测出NaCl的体积;
(4)根据NaCl的密度和晶体的体积计算出一个NaCl晶胞的质量,根据1molNaCl的质量、摩尔质量和阿伏加德罗常数的关系计算阿伏加德罗常数;
(5)根据晶胞的结构计算纳米颗粒的表面原子占总原子数的百分比.
解答:解:(1)定容容器为容量瓶,具有一定体积并便于振荡,故答案为:容量瓶;
(2)苯具有腐蚀性,易腐蚀碱式滴定管中的橡皮管,只能用酸式滴定管,故答案为:酸式滴定管;因苯能腐蚀碱式滴定管的橡皮管(溶解);
(3)测量mgNaCl固体的体积,所加溶剂不能溶解NaCl,否则无法测出NaCl的体积,所以不能用水,应用苯,
故答案为:不能;因NaCl溶于水,无法测出NaCl的体积;
(4)NaCl的密度为
g/cm3,
NaCl晶胞的体积为(2a)3cm3,
则NaCl晶胞的质量为
×(2a)3g,
一个NaCl晶胞含4个“NaCl”,
而每个“NaCl”的质量为
=
g,
故:
×(2a)3=4×
,
即NA=
=
,故答案为NA=
;
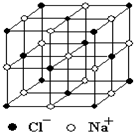
(5)由NaCl的晶胞图可知,
NaCl的晶胞为正立方体结构,
立方体的体心只有一个Na+,
而其它的离子都处在立方体的面上,
晶胞中的总原子数为27个,
而表面上就有26个,
故“NaCl”纳米颗粒的表面原子占总原子数的百分比为
×100%=97%,故答案为:97%.
(2)苯具有腐蚀性,易腐蚀碱式滴定管中的橡皮管,只能用酸式滴定管,故答案为:酸式滴定管;因苯能腐蚀碱式滴定管的橡皮管(溶解);
(3)测量mgNaCl固体的体积,所加溶剂不能溶解NaCl,否则无法测出NaCl的体积,所以不能用水,应用苯,
故答案为:不能;因NaCl溶于水,无法测出NaCl的体积;
(4)NaCl的密度为
| m |
| (V1-V2) |
NaCl晶胞的体积为(2a)3cm3,
则NaCl晶胞的质量为
| m |
| (V1-V2) |
一个NaCl晶胞含4个“NaCl”,
而每个“NaCl”的质量为
| M(NaCl) |
| NA |
| 58.5 |
| NA |
故:
| m |
| (V1-V2) |
| 58.5 |
| NA |
即NA=
| 4×58.5×(V1-V2) |
| m×(2a)3 |
| 58.5×(V1-V2) |
| 2ma3 |
| 58.5×(V1-V2) |
| 2ma3 |
(5)由NaCl的晶胞图可知,
NaCl的晶胞为正立方体结构,
立方体的体心只有一个Na+,
而其它的离子都处在立方体的面上,
晶胞中的总原子数为27个,
而表面上就有26个,
故“NaCl”纳米颗粒的表面原子占总原子数的百分比为
| 26 |
| 27 |
点评:本题考查晶胞的结构分析和阿伏加德罗常数的测定,题目较难,注意根据1molNaCl的质量、摩尔质量和阿伏加德罗常数的关系计算阿伏加德罗常数.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
(文科必答)化学是材料科学发展的基础,随着科学技术的发展,已研制出许多新型材料.下列属于新型陶瓷材料的是( )
| A、玻璃 | B、水泥 | C、生物陶瓷 | D、陶瓷 |