网址:http://m.1010jiajiao.com/timu3_id_46040[举报]
①4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
![]()
③SO3+H2O ![]() H2SO4
H2SO4
其中排放的尾气含少量SO2,为防止污染大气,在排放前应设法进行综合利用。
(1)某硫酸厂每天排放10000m3(换算成标准状况下体积)尾气中含0.2%(体积分数)的SO2,问用NaOH溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(CaSO4·2H2O)?
(2)如果将一定体积的尾气通入100mL2mol·L-1的NaOH溶液使其完全反应,经测定所得溶液含
(3)工厂在尾气处理制石膏的过程中,中间产物是NaHSO3,调节尾气排放的流量,以取得SO2和NaOH间物质的量的最佳比值,从而提高NaHSO3的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示SO2、NaOH、NaHSO3的物质的量,且![]() =x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
=x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
x=n(SO2)/n(NaOH) | n(NaHSO3) |
|
|
|
|
|
|
提示:该题取材于接触法制硫酸的过程中对废气SO2的处理,即消除了SO2对空气的污染,又使SO2得到综合利用。该题在能力要求上有一定的深度和坡度。第(1)步考查多步反应的计算,所发生的一系列反应较为复杂,但根据S元素守恒找出关系式,即可得出答案。第(2)步涉及平行反应中混合物的计算。反应方程式为2NaOH+SO2 ![]() Na2SO3+H2O;NaOH+SO2
Na2SO3+H2O;NaOH+SO2 ![]() NaHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
NaHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
接触法制H2SO4的基本原理是:
①4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
②2SO2+O2 ![]() 2SO3
2SO3
③SO3+H2O ![]() H2SO4
H2SO4
其中排放的尾气含少量SO2,为防止污染大气,在排放前应设法进行综合利用。
(1)某硫酸厂每天排放10000m3(换算成标准状况下体积)尾气中含0.2%(体积分数)的SO2,问用NaOH溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(CaSO4·2H2O)?
(2)如果将一定体积的尾气通入100mL2mol·L-1的NaOH溶液使其完全反应,经测定所得溶液含16.7g溶质。试分析溶液的成分,并计算各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是NaHSO3,调节尾气排放的流量,以取得SO2和NaOH间物质的量的最佳比值,从而提高NaHSO3的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示SO2、NaOH、NaHSO3的物质的量,且![]() =x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
=x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
| x=n(SO2)/n(NaOH) | n(NaHSO3) |
提示:该题取材于接触法制硫酸的过程中对废气SO2的处理,即消除了SO2对空气的污染,又使SO2得到综合利用。该题在能力要求上有一定的深度和坡度。第(1)步考查多步反应的计算,所发生的一系列反应较为复杂,但根据S元素守恒找出关系式,即可得出答案。第(2)步涉及平行反应中混合物的计算。反应方程式为2NaOH+SO2 ![]() Na2SO3+H2O;NaOH+SO2
Na2SO3+H2O;NaOH+SO2 ![]() aHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
aHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
(1)由A、B组成混合物的平均分子式为
(2)另取一定量的A和B完全燃烧,将其以任意物质的量比混合,且物质的量之和一定.
①若耗氧量一定,则A、B的分子式分别是
②若生成的二氧化碳和水的物质的量一定,则A、B的分子式分别是
(3)另取a mol 的以任意比混合的A和B的混合物,在过量的氧气中完全燃烧.
①若耗氧量为定值,则耗氧量为
②若生成的CO2的量为定值,则生成物水的质量范围为
(1)SO2和O2反应制取SO3的反应原理为:2SO2+O2
| 催化剂 |
| △ |
①该反应的平衡常数表达式为:
| c2(SO3) |
| c(O2)?c2(SO2) |
| c2(SO3) |
| c(O2)?c2(SO2) |
②该反应达到平衡状态的标志是
A.v(SO2)=v(SO3) B.混合物的平均相对分子质量不变
C.混合气体质量不变 D.各组分的体积分数不变
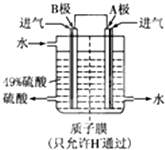
(2)某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.
①B电极的电极反应式为
②溶液中H+的移动方向由
电池总反应式为
(3)利用烧渣制绿矾的过程如下:
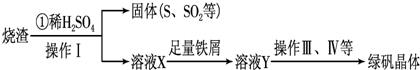
测定绿矾产品中含量的实验步骤:
a.称取5.7g产品,溶解,配成250mL溶液
b.量取25mL待测液于锥形瓶中
c.用硫酸酸化的0.01mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式).
| O | - 4 |
②用硫酸酸化的KMnO4滴定终点的标志是
③计算上述产品中FeSO4?7H2O的质量分数为
 在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,如图表示加入的混合物质量与产生的气体体积(标准状况)的关系,试计算:
在100mL NaOH溶液中加入NH4NO3和(NH4)2SO4的固体混合物,加热充分反应,如图表示加入的混合物质量与产生的气体体积(标准状况)的关系,试计算: