��Ŀ����
�Ӵ�����H2SO4�Ļ���ԭ���ǣ� ��4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
![]()
��SO3+H2O ![]() H2SO4
H2SO4
�����ŷŵ�β��������SO2��Ϊ��ֹ��Ⱦ���������ŷ�ǰӦ�跨�����ۺ����á�
(1)ij���᳧ÿ���ŷ�10000m3(����ɱ�״�������)β���к�0.2%(�������)��SO2������NaOH��Һ��ʯ�Ҽ���������������Ԫ�ز���ʧ�������Ͽɵõ�����ǧ��ʯ��(CaSO4��2H2O)��
(2)�����һ�������β��ͨ��100mL2mol��L-1��NaOH��Һʹ����ȫ��Ӧ�����ⶨ������Һ��
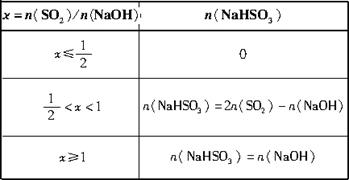
(3)������β��������ʯ��Ĺ����У��м������NaHSO3������β���ŷŵ���������ȡ��SO2��NaOH�����ʵ�������ѱ�ֵ���Ӷ����NaHSO3�IJ���������n(SO2)��n(NaOH)��n(NaHSO3)�ֱ��ʾSO2��NaOH��NaHSO3�����ʵ�������![]() =x,��д��x�ڲ�ͬȡֵ��Χʱ��n(NaHSO3)��ֵ��n(NaHSO3)��n(SO2)��n(NaOH)��Ĺ�ϵʽ��
=x,��д��x�ڲ�ͬȡֵ��Χʱ��n(NaHSO3)��ֵ��n(NaHSO3)��n(SO2)��n(NaOH)��Ĺ�ϵʽ��
x=n(SO2)/n(NaOH) | n(NaHSO3) |
|
|
|
|
|
|
��ʾ������ȡ���ڽӴ���������Ĺ����жԷ���SO2�Ĵ�������������SO2�Կ�������Ⱦ����ʹSO2�õ��ۺ����á�����������Ҫ������һ������Ⱥ��¶ȡ���(1)������ಽ��Ӧ�ļ��㣬��������һϵ�з�Ӧ��Ϊ���ӣ�������SԪ���غ��ҳ���ϵʽ�����ɵó��𰸡���(2)���漰ƽ�з�Ӧ�л����ļ��㡣��Ӧ����ʽΪ2NaOH+SO2 ![]() Na2SO3+H2O;NaOH+SO2
Na2SO3+H2O;NaOH+SO2 ![]() NaHSO3�����������������������Ӧ���ü�ֵ���跨���з������ۡ���(3)������������з�Χ���۵Ļ���֪ʶ���Լ����������ƽ�з�Ӧ�ļ��㡣
NaHSO3�����������������������Ӧ���ü�ֵ���跨���з������ۡ���(3)������������з�Χ���۵Ļ���֪ʶ���Լ����������ƽ�з�Ӧ�ļ��㡣
������(1)���CaSO4��2H2O������Ϊy��
����SԪ���غ��У�
SO2 �� CaSO4��2H2O
104��103��0.2%L? y
y=
(2)������ȫΪNa2SO3����ӦΪ
2NaOH+SO2 ![]() Na2SO3+H2O
Na2SO3+H2O
![]()
������ȫΪNaHSO3������ݷ�Ӧ
NaOH+SO2 ![]() NaHSO3
NaHSO3
m(NaHSO3)=
����20.8��16.7��12.6,��������ΪNa2SO3��NaHSO3�Ļ��Һ��
��������NaHSO3�����ʵ���Ϊm,Na2SO3�����ʵ���Ϊn��
�ⷨһ��

��֮���ã�m=0.1mol,?n=0.05mol
�ⷨ��������ƽ����ʽ����
(2n+m)NaOH+(m+n)SO2 ![]() nNa2SO3+mNaHSO3+nH2O
nNa2SO3+mNaHSO3+nH2O
����
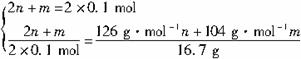
m=0.1mol n=0.05mol
(3)SO2ͨ��NaOH��Һʱ���ܷ����ķ�ӦΪ
2NaOH+SO2 ![]() Na2SO3+H2O(��)
Na2SO3+H2O(��)
NaOH+SO2 ![]() NaHSO3(��)
NaHSO3(��)
�ٵ�x=![]() ��
��![]() ʱ����Ӧ��(��)ʽ���У�SO2ȫ����Ӧ���������ΪNa2SO3,��n(NaHSO3)=0��
ʱ����Ӧ��(��)ʽ���У�SO2ȫ����Ӧ���������ΪNa2SO3,��n(NaHSO3)=0��
�ڵ�x=![]() ��1ʱ����Ӧ��(��)ʽ���У�NaOHȫ����Ӧ��������ȫ��NaHSO3����n(NaHSO3)=n(NaOH)��
��1ʱ����Ӧ��(��)ʽ���У�NaOHȫ����Ӧ��������ȫ��NaHSO3����n(NaHSO3)=n(NaOH)��
�۵�![]() ��x��1ʱ��(��)(��)������Ӧƽ�н��У�NaOH��SO2�����ʾ��ľ�������NaHSO3��Na2SO3�Ļ�������(2)���ķ������С�
��x��1ʱ��(��)(��)������Ӧƽ�н��У�NaOH��SO2�����ʾ��ľ�������NaHSO3��Na2SO3�Ļ�������(2)���ķ������С�
n(NaHSO3)+2n(Na2SO3)=n(NaOH) (Na+�غ�)
n(Na2SO3)+n(NaHSO3)=n(SO2) (S�غ�)
��֮,��n(NaHSO3)=2n(SO2)-n(NaOH)
�𰸣�

 �����ƻ���ĩ��̶�100��ϵ�д�
�����ƻ���ĩ��̶�100��ϵ�д� �ܿ���ȫ��100��ϵ�д�
�ܿ���ȫ��100��ϵ�д�ʵ�� | �����Ʒ������/g | NaOH��Һ�����/mL | ���������/L |
1 | 3.62 | 50.00 | 0.896 |
2 | 7.24 | 50.00 | 1.792 |
3 | 10.86 | 50.00 | 2.016 |
4 | 14.48 | 50.00 | 1.568 |
(1)��1������ֱ���Ʋ⣬1.81 g��Ʒ����ͬ��ʵ��ʱ�����ɰ���������������Ϊ________ L��
��2���Լ���û�����У�NH4��2SO4��NH4HSO4�����ʵ���֮��Ϊ___________��
��3��������NaOH��Һ�����ʵ���Ũ��Ϊ___________ mol��L-1��
�Ӵ�����H2SO4�Ļ���ԭ���ǣ�
��4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
��2SO2+O2 ![]() 2SO3
2SO3
��SO3+H2O ![]() H2SO4
H2SO4
�����ŷŵ�β��������SO2��Ϊ��ֹ��Ⱦ���������ŷ�ǰӦ�跨�����ۺ����á�
��1��ij���᳧ÿ���ŷ�10000m3������ɱ�״���������β���к�0.2%�������������SO2������NaOH��Һ��ʯ�Ҽ���������������Ԫ�ز���ʧ�������Ͽɵõ�����ǧ��ʯ�ࣨCaSO4��2H2O����
��2�������һ�������β��ͨ��100mL2mol��L-1��NaOH��Һʹ����ȫ��Ӧ�����ⶨ������Һ��16.7g���ʡ��Է�����Һ�ijɷ֣���������ɷֵ����ʵ�����
��3��������β��������ʯ��Ĺ����У��м������NaHSO3������β���ŷŵ���������ȡ��SO2��NaOH�����ʵ�������ѱ�ֵ���Ӷ����NaHSO3�IJ���������n��SO2����n��NaOH����n��NaHSO3���ֱ��ʾSO2��NaOH��NaHSO3�����ʵ�������![]() =x,��д��x�ڲ�ͬȡֵ��Χʱ��n��NaHSO3����ֵ��n��NaHSO3����n��SO2����n��NaOH����Ĺ�ϵʽ��
=x,��д��x�ڲ�ͬȡֵ��Χʱ��n��NaHSO3����ֵ��n��NaHSO3����n��SO2����n��NaOH����Ĺ�ϵʽ��
| x=n��SO2��/n��NaOH�� | n��NaHSO3�� |
��ʾ������ȡ���ڽӴ���������Ĺ����жԷ���SO2�Ĵ�������������SO2�Կ�������Ⱦ����ʹSO2�õ��ۺ����á�����������Ҫ������һ������Ⱥ��¶ȡ��ڣ�1��������ಽ��Ӧ�ļ��㣬��������һϵ�з�Ӧ��Ϊ���ӣ�������SԪ���غ��ҳ���ϵʽ�����ɵó��𰸡��ڣ�2�����漰ƽ�з�Ӧ�л����ļ��㡣��Ӧ����ʽΪ2NaOH+SO2 ![]() Na2SO3+H2O;NaOH+SO2
Na2SO3+H2O;NaOH+SO2 ![]() aHSO3�����������������������Ӧ���ü�ֵ���跨���з������ۡ��ڣ�3��������������з�Χ���۵Ļ���֪ʶ���Լ����������ƽ�з�Ӧ�ļ��㡣
aHSO3�����������������������Ӧ���ü�ֵ���跨���з������ۡ��ڣ�3��������������з�Χ���۵Ļ���֪ʶ���Լ����������ƽ�з�Ӧ�ļ��㡣