摘要:电化学知识(近10年来的化学高考命题中的呈现率:100%) [点题]用惰性电极电解一定浓度的硫酸铜溶液.通电一段时间后.向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和PH.则电解过程中转移的电子数为( ) A.0.1mol B.0.2mol C.0.3mol D.0.4mol [点晴] 错误解答:选B.由于电解后加入0.1mol Cu(OH)2.恰好恢复到电解前.而0.1mol Cu(OH)2中含0.1molCu2+.即反应过程中有0.1molCu2+被还原.因此电解过程中共有0.2mol电子发生转移.错误原因:对电解硫酸铜溶液的反应没有深入的掌握.而且忽略了题目中加入的物质为Cu(OH)2.正确解答:电解硫酸铜溶液的反应方程式为: 2CuSO4 + 2H2O = 2Cu+ 2H2SO4 + O2↑ 从上述方程式可以看出.电解硫酸铜过程中.只析出铜和释放出氧气.因此.电解前后只有铜和氧的改变.电解后加入CuO就可以使溶液恢复原来状态.但本题提示加入Cu(OH)2后溶液恢复原来状态.说明电解过程中不仅硫酸铜被电解.而且有水被电解.0.1molCu(OH)2可以可以看作是0.1mol的CuO和0.1mol H2O.因此电解过程中有0.1mol的硫酸铜和0.1mol的水被电解.故选D. [点题]消毒.杀菌.是抗“非典 消毒剂.一种家用环保消毒液产生装置.其原理中用石墨作电极电解饱和氯化钠溶液.制得有较强杀菌能力的消毒液.该仪器的原理如图所示. 试回答:(1)“84 消毒液在日常生活中被广泛使用.该消毒液无色. pH大于7.对某些有色物质有漂白作用.你认为它可能的有效成分 是 A.SO2 B.Na2CO3 C.KMnO4 D.NaClO (2)写出电极名称 a极 .b极 . (3)消毒液的有效成分是 . (4)写出有关离子方程式 . (5)若在电解过程中因温度上升.生成了少量的NaClO3.即发生了反应:3Cl2 + 6 NaOH =5 NaCl + NaClO3 + 3H2O 测量得n :n(NaClO3) = 5∶1.则整个过程中.氧化产物与还原产物的物质的量之比是 . [点晴] 由"为使氯气完全被吸收"应在电解槽下部产生氯气.故a极为负极.b极为正极.(3)由方程式:Cl2 + 2 NaOH = NaCl + NaClO + H2O有效成分为:NaClO (4)2Cl- + H2O=2 OH- + H2↑ + Cl2↑ Cl2 + 2OH-= Cl- + ClO- + H2O (5)由于整个过程氯气完全被吸收.氯化钠.水为原料.所以H2. NaClO与NaClO3为产物,其中H2为还原产物.和为氧化产物.由:1mol Cl→1mol ClO-失电子2 mol.1mol Cl→1mol ClO3-失电子6 mol.若设NaClO为5 mol则NaClO3为1mol.氧化产物为6mol.共失电子:5 mol×2 + 6 mol = 16mol.而生成1mol H2需转移电子2mol.则:n(H2)= 16mol/2 = 8 mol.故氧化产物与还原产物的物质的量之比是: 6:8=3:4 [点题]熔融碳酸盐燃料电池.发明于1889 年.上世纪的30~60年代在荷兰得到广泛的发 展.而且建成了寿命超过40000小时的电池. 可应用于中心电站. 现有一个碳酸盐燃料电池.以一定比例 Ll2CO3和Na2CO3低熔混合物为电解质.操作温 度为650℃.在此温度下以镍为催化剂.以煤 气(CO.H2)直接作燃料.其工作原理如图所示. 请回答下列问题: (1)B极为 极.发生 反应.该极发生的电极反应为 , Ni (2)电池总反应为 . 650℃ [点晴](1)正 还原 2CO2 + O2 + 4e = 2CO32― (2)CO + H2 + O2 CO2 +H2O
网址:http://m.1010jiajiao.com/timu3_id_46029[举报]
 复习电化学知识后,某学生设计了一个“黑笔写彩字”的趣味实验.滤纸先用某混合溶液浸湿,然后平铺在一块铂片上,右端是C、Cu两电极浸入氯化铁溶液中,电路接通后,用铅笔在滤纸上写字,会出现彩色字迹.据此判断电极材料与反应现象均正确的是 复习电化学知识后,某学生设计了一个“黑笔写彩字”的趣味实验.滤纸先用某混合溶液浸湿,然后平铺在一块铂片上,右端是C、Cu两电极浸入氯化铁溶液中,电路接通后,用铅笔在滤纸上写字,会出现彩色字迹.据此判断电极材料与反应现象均正确的是( )
|
查看习题详情和答案>>
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键的步骤.
(1)某温度下,SO2(g)+
O2(g)?SO3(g);△H=-98kJ?mol-1.开始时在100L的密闭容器中加入4.0mol SO2(g)和10.0molO2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=
(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生反应:2SO2(g)+O2(g)?2SO3(g),达平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是
A.保持温度和容器不变,充入2molSO3
B.保持温度和容器体积不变,充入2molN2
C.保持温度和容器内压强不变,充入1molSO3
D.移动活塞压缩气体
E.升高温度
(3)下列关于2SO2(g)+O2(g)?2SO3(g)反应的图象中,不正确的是

(4)同学们学习了电化学知识后大家提出,可以用电解的方法来生产硫酸,可避免产生酸雨,污染环境.于是大家设计了一个以铂为电极,两极分别通入SO2和空气,酸性电解液来实现电解生产硫酸.
①阳极的电极反应为
②若电解液为2L 0.025mol?L-1的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为
③设计此实验的想法得到了老师的充分肯定,但与工业上生产硫酸相比还是有很多不足,请对此实验进行合理的评价
查看习题详情和答案>>
(1)某温度下,SO2(g)+
| 1 | 2 |
3.33
3.33
.(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生反应:2SO2(g)+O2(g)?2SO3(g),达平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是
AD
AD
(填字母).A.保持温度和容器不变,充入2molSO3
B.保持温度和容器体积不变,充入2molN2
C.保持温度和容器内压强不变,充入1molSO3
D.移动活塞压缩气体
E.升高温度
(3)下列关于2SO2(g)+O2(g)?2SO3(g)反应的图象中,不正确的是
C
C
.
(4)同学们学习了电化学知识后大家提出,可以用电解的方法来生产硫酸,可避免产生酸雨,污染环境.于是大家设计了一个以铂为电极,两极分别通入SO2和空气,酸性电解液来实现电解生产硫酸.
①阳极的电极反应为
SO2+2H2O-2e-=SO42-+4H+
SO2+2H2O-2e-=SO42-+4H+
.②若电解液为2L 0.025mol?L-1的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为
1.12L
1.12L
,此溶液的pH=1
1
(忽略溶液体积变化).③设计此实验的想法得到了老师的充分肯定,但与工业上生产硫酸相比还是有很多不足,请对此实验进行合理的评价
耗费大量的电能,不经济,产率低,不能大规模生成
耗费大量的电能,不经济,产率低,不能大规模生成
(写出一点即可).工业制硫酸时,利用催化氧化反应将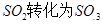 是一个关键的步骤。
是一个关键的步骤。
(1)某温度下, 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
(2)一定条件下,向一带活塞的密闭容器中充入2mol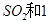 mol
mol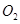 ,发生反应:
,发生反应: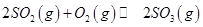 ,达平衡后改变下述条件,
,达平衡后改变下述条件,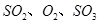 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。
A.保持温度和容器体积不变,充入2mol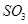
B.保持温度和容器体积不变,充入2molN2
C.保持温度和容器内压强不变,充入1mol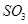
D.移动活塞压缩气体
E.升高温度
(3)下列关于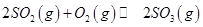 反应的图像中,不正确的是_________。
反应的图像中,不正确的是_________。
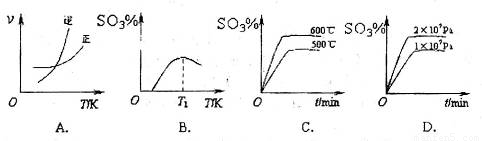
(4)同学们学习了电化学知识后大家提出,可以用电解的方法来生产硫酸,可避免产生酸雨,污染环境。于是大家设计了一个以铂为电极,两极分别通入SO2和空气,酸性电解液来实现电解生产硫酸。
①阳极的电极反应为______________________________。
②若电解液为2L0.025mol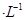 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH=__________
(忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH=__________
(忽略溶液体积变化)。
③设计此实验的想法得到了老师的充分肯定,但与工业上生产硫酸相比还是有很多不足,请对此实验进行合理的评价____________________________(写出一点即可)。
查看习题详情和答案>>