摘要:下图是一些有机物的相互转化关系.其中C和D按1∶2反应生成N.M与N互为同分异构体. (1)写出下列反应的化学方程式:CH2=CH2 [O]-→E HO-CH2- -CH2OH + F →M (2)与HO-CH2- -CH2OH互为同分异构体.属于酚类且苯环上只有两个互为对位的取代基的化合物有4种,其结构简式为:(已写出2种,请再写出另2种) HO- -OCH2CH3.HO- -CH2OCH3 , (3)A的结构简式可能为
网址:http://m.1010jiajiao.com/timu3_id_45394[举报]
Ⅰ、某有机物的结构确定:①测定实验式:某含C、H、O三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是 .
②确定分子式:下图是该有机物的质谱图,则其相对分子质量为 ,分子式为 .
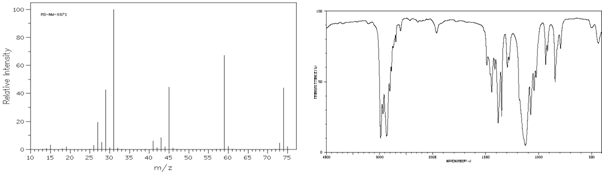
③经测得该有机物的红外光谱如下,请写出该有机物分子的结构简式
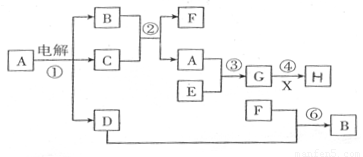
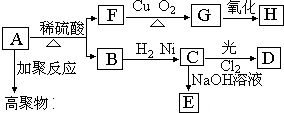
Ⅱ、某高聚物的单体A(C11H12O2)可发生以下变化;已知C的一氯代物D有两种,F的分子式为C7H8O,含苯环,与FeCl3溶液不显色.
请回答:
(1)B表示分子中含有的官能团是 、 .
(2)由B转化为C的反应属于(选填序号) .
①氧化反应 ②还原反应 ③加成反应 ④取代反应
(3)与B具有相同官能团的同分异构体有 种(包含B).
(4)A的结构简式是 .
(5)用方程式分别表示
F→G ;
C→D 或 .
查看习题详情和答案>>
②确定分子式:下图是该有机物的质谱图,则其相对分子质量为

③经测得该有机物的红外光谱如下,请写出该有机物分子的结构简式
Ⅱ、某高聚物的单体A(C11H12O2)可发生以下变化;已知C的一氯代物D有两种,F的分子式为C7H8O,含苯环,与FeCl3溶液不显色.

请回答:
(1)B表示分子中含有的官能团是
(2)由B转化为C的反应属于(选填序号)
①氧化反应 ②还原反应 ③加成反应 ④取代反应
(3)与B具有相同官能团的同分异构体有
(4)A的结构简式是
(5)用方程式分别表示
F→G
C→D
下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去.常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质.反应①②均为工业上的重要反应.

请回答下列问题:
(1)写出下列物质的化学式A
(2)写出F与NaOH反应的化学方程式
(3)写出B与C高温反应生成E和F的化学方程式:
(4)写出D与J的稀溶液反应生成G的离子方程式:
(5)写出H与强碱反应后一段时间内所能观察出的现象
查看习题详情和答案>>

请回答下列问题:
(1)写出下列物质的化学式A
CO
CO
KFeCl3
FeCl3
LNaAlO2
NaAlO2
.(2)写出F与NaOH反应的化学方程式
Al2O3+2NaOH=2NaAlO2+H2O
Al2O3+2NaOH=2NaAlO2+H2O
.(3)写出B与C高温反应生成E和F的化学方程式:
Fe2O3+2Al
A12O3+2Fe
| ||
Fe2O3+2Al
A12O3+2Fe
.试列举该反应在工业生产中的应用
| ||
焊接铁轨
焊接铁轨
.(4)写出D与J的稀溶液反应生成G的离子方程式:
CO2+CO32-+H2O=2HCO3-
CO2+CO32-+H2O=2HCO3-
.(5)写出H与强碱反应后一段时间内所能观察出的现象
先生成白色沉淀,迅速变为灰绿色沉淀,最后变为红褐色沉淀
先生成白色沉淀,迅速变为灰绿色沉淀,最后变为红褐色沉淀
.(I)下图是一些常见的单质.化合物之间的转化关系图,有些反应中的部分物质被略去.A为含14个电子的双原子分子,C.E为金属单质,B化合物中含E原子质量含量为70%.反应①②均为工业上的重要反应.

请回答下列问题:
(1)D的电子式为
 .
.
(2)K的化学式为
(3)写出B与C高温反应生成E和F的化学方程式:
(4)写出D与J的稀溶液反应生成G的离子方程式:
(5)I→L的离子方程式
(II)随着尖端技术的发展,氟的用途日益广泛,如用F2将UF4氧化成UF6,然后用气体扩散法使铀的同位素235U和238U分离.而氟单质的制备通常采用电解氧化法.下图是电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物,其装置如图:
(1)已知阴极的反应为:2HF2-+2e-=H2+4F-则电解的总反应为:
(2)出口1是(写化学式,下同)
(3)在电解质的熔盐中常加入另一种氟化物(AlF3),他的作用是①减少HF的挥发②
(4)随着电解的进行有一种物质会不断被消耗,需要从入口处进行补充,则从入口处加入的物质是(写化学式)
(5)化学家Karl Chrite首次用化学方法制的氟,这是1986年合成化学研究上的一大突破.具体制法为:
①4KMnO4+4KF+20HF=4K2MnF6+10H2O+3O2
②SbCl5+5HF=SbF5+5HCl
③2K2MnF6+4SbF5
4KSbF6+2MnF3+F2
则下列说法正确的是
A.反应①中KMnO4既是氧化剂又是还原剂,K2MnF6是氧化产物
B.反应③中K2MnF6一定是氧化剂可能还起到还原剂的作用,SbF5一定不是氧化剂
C.反应②能够发生可能原因是生成稳定的络合物SbF5的缘故
D.生成0.5mol的F2整个反应过程中转移的电子总数是4NA个.
查看习题详情和答案>>

请回答下列问题:
(1)D的电子式为


(2)K的化学式为
FeCl3
FeCl3
.(3)写出B与C高温反应生成E和F的化学方程式:
Fe2O3+Al
Fe+Al2O3
| ||
Fe2O3+Al
Fe+Al2O3
.
| ||
(4)写出D与J的稀溶液反应生成G的离子方程式:
CO2+OH-=HCO3-
CO2+OH-=HCO3-
.(5)I→L的离子方程式
Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
.
(II)随着尖端技术的发展,氟的用途日益广泛,如用F2将UF4氧化成UF6,然后用气体扩散法使铀的同位素235U和238U分离.而氟单质的制备通常采用电解氧化法.下图是电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物,其装置如图:
(1)已知阴极的反应为:2HF2-+2e-=H2+4F-则电解的总反应为:
2KHF2
2KF+H2↑+F2↑
| ||
2KHF2
2KF+H2↑+F2↑
.
| ||
(2)出口1是(写化学式,下同)
F2
F2
,出口2是H2
H2
.(3)在电解质的熔盐中常加入另一种氟化物(AlF3),他的作用是①减少HF的挥发②
降低电解质的熔点
降低电解质的熔点
.(4)随着电解的进行有一种物质会不断被消耗,需要从入口处进行补充,则从入口处加入的物质是(写化学式)
HF
HF
.(5)化学家Karl Chrite首次用化学方法制的氟,这是1986年合成化学研究上的一大突破.具体制法为:
①4KMnO4+4KF+20HF=4K2MnF6+10H2O+3O2
②SbCl5+5HF=SbF5+5HCl
③2K2MnF6+4SbF5
| ||
则下列说法正确的是
C
C
.A.反应①中KMnO4既是氧化剂又是还原剂,K2MnF6是氧化产物
B.反应③中K2MnF6一定是氧化剂可能还起到还原剂的作用,SbF5一定不是氧化剂
C.反应②能够发生可能原因是生成稳定的络合物SbF5的缘故
D.生成0.5mol的F2整个反应过程中转移的电子总数是4NA个.
 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:(1)反应①的基本反应类型是
化合反应
化合反应
;(2)C的化学式为
Fe
Fe
;(3)写出物质E和B在加热条件下反应的化学方 程式
H2+CuO
Cu+H2O
| ||
H2+CuO
Cu+H2O
;
| ||
(4)将浅绿色溶液D转化为黄色溶液的方法是(用离子方程式表示)
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
.(5)乙醇在A作催化剂的条件下可以被空气中的氧气催化氧化,试写出该反应的化学方程式:
2CH3CH2OH+O2
2CH3CHO+2H2O
| Cu |
2CH3CH2OH+O2
2CH3CHO+2H2O
.| Cu |