网址:http://m.1010jiajiao.com/timu3_id_45110[举报]
已知:A、B、D为中学化学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol丁分子中不同原子的数目比为1∶2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如下图所示(某些条件已略去).

请回答:
(1)单质A的组成元素在周期表中的位置是________.
(2)乙中所包含的化学键类型有________(填字母序号).
a.离子键
b.极性共价键
c.非极性共价键
(3)用电子式表示丙分子的形成过程________.
(4)反应①的化学方程式为________.
(5)丁的电子式为________.
(6)反应②中,0.5 mol NaClO参加反应时,转移1 mol电子,其离子方程式为:________.
(7)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为________.
工业上以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿的主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。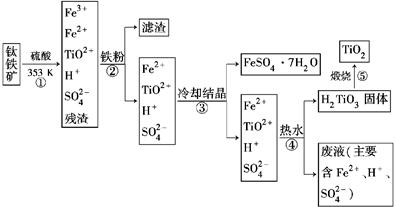
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的离子方程式为_______________________
(2)步骤③中,实现混合物的分离是利用物质的________(填字母序号)。
a.熔、沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均需要进行的操作是________(填操作名称)。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:
____________________________________________________________。
(5)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应可生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为__________________________________
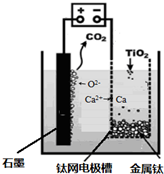
(6)研究发现,用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置可获得金属钙,并可以钙为还原剂,还原二氧化钛制备金属钛。
写出阳极的电极反应式:_________________________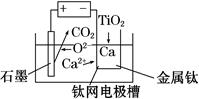
在制备金属钛前后,CaO的总量不变,其原因是______________________________________(请结合化学用语解释)。

已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的离子方程式为_______________________
(2)步骤③中,实现混合物的分离是利用物质的________(填字母序号)。
a.熔、沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均需要进行的操作是________(填操作名称)。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:
____________________________________________________________。
(5)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应可生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为__________________________________
(6)研究发现,用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置可获得金属钙,并可以钙为还原剂,还原二氧化钛制备金属钛。
写出阳极的电极反应式:_________________________

在制备金属钛前后,CaO的总量不变,其原因是______________________________________(请结合化学用语解释)。
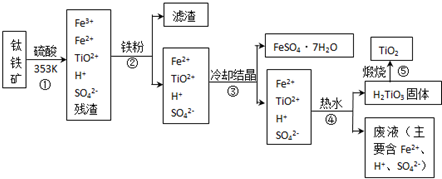
已知:TiOSO4遇水会水解.
(1)写出相应的离子方程式:
步骤①中,钛元素从钛铁矿中溶入溶液时发生的反应为:
步骤②中,用铁粉将Fe3+转化为Fe2+的反应的为
(2)步骤③中,实现混合物的分离是利用物质的
a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的分离操作是
(4)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),则反应的离子方程式为
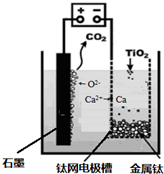
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.写出阳极所发生反应的电极反应式: