网址:http://m.1010jiajiao.com/timu3_id_45052[举报]
某化学学习小组同学根据实验室现有的制取氨气的药品,设计了右图所示的实验装置(部分夹持仪器未画出),制取并探究氨气的还原性、检验反应产物。请回答下列问题:
(1)A中发生反应的化学方程式是 。
(2)B中碱石灰的作用是 。
(3)C中黑色固体变红,且产生的气体对空气无污染,写出该反应的化学方程式 ;D中发生的现象是__________________________。
(4)该装置存在明显缺陷,该缺陷是 。
(5)工业中常用氮气与氢气在高温、高压、铁触媒做催化剂的条件下合成氨气,该小组同学模拟该条件也合成出了氨气。已知起始时,将2 mol N2、6 mol H2充入一个容积为2 L的密闭容器中发生反应,过了5 min后,混合气体的总物质的量减少了1 mol,求在这段时间内以H2表示的化学反应速率为 。

查看习题详情和答案>>
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |
(1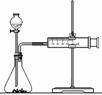 )该同学的实验目的是________________________________;
)该同学的实验目的是________________________________;
要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图
装置进行定量实验。完成该实验应选用的实验药品是______;
应该测定的实验数据是____________________________。
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是__________________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是____
A、硫酸钾 B、硫酸锰 C、氯化锰 D、水
查看习题详情和答案>>已知反应:3I-(aq)+S2O82-(aq) ![]() I3-(aq)+2SO42-(aq);
I3-(aq)+2SO42-(aq);
(1)写出反应的平衡常数表达式 K= 。
(2)右图表示反应过程中有关物质的能量,则反应的△H 0(填>、<、=)。
(I)、(II)两线中,使用催化剂的是 线。
(3)反应中发生反应的I-与被氧化的I-的物质的量比为 。
(4)反应的速率可以用I3-与加入的淀粉溶液反应是蓝色的
时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:
实验编号 | ① | ② | ③ | ④ | ⑤ |
c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
c(S2O82-/mol·L-1) | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
t/s | 88 | 44 | 22 | 11 | t1 |
则:该实验的目的是
显色时间t1= s
分析表中数据,得出的结论是
查看习题详情和答案>>
(18分)化学在能源开发与利用中起到十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ (1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量。则表示氢气燃烧热的热化学方程式为: 。
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极)。分析该装置、回答下列问题:
(2)氢氧燃料电池中,a电极为电池的是 (填“正极”或“负极”),气体M的分子式 ,a电极上发生的电极反应式为: 。
(3)若右上图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态。则在此电解过程中导线上转移的电子数为 mol。(保留小数点后2位)
Ⅱ 氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g)2NH3 (g) ΔH=-92.2kJ·mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是 。
① N2、H2 、NH3的体积分数不再改变;
② 单位时间内生成2n mol NH3的同时生成3n mol H2;
③ 单位时间内生成3n mol N—H键的同时生成n mol N≡N;
④ 用N2、H2 、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤ 混合气体的平均摩尔质量不再改变;
⑥ 混合气体的总物质的量不再改变。
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:
根据表中数据计算:
①反应进行到2小时时放出的热量为 kJ。
②0~1小时内N2的平均反应速率 mol·L-1·h-1。
③此条件下该反应的化学平衡常数K== (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2 和NH3各1 mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”。)
查看习题详情和答案>>
(18分)化学在能源开发与利用中起到十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ (1)在298K、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量。则表示氢气燃烧热的热化学方程式为: 。
氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图饱和食盐水电解实验(图中所用电极均为惰性电极)。分析该装置、回答下列问题:
(2)氢氧燃料电池中,a电极为电池的是 (填“正极”或“负极”),气体M的分子式 ,a电极上发生的电极反应式为: 。
(3)若右上图装置中盛有100mL5.0mol/LNaCl溶液,电解一段时间后须加入10.0mol/L盐酸溶液50mL(密度为1.02g/mL)才能使溶液恢复至原来状态。则在此电解过程中导线上转移的电子数为 mol。(保留小数点后2位)
Ⅱ 氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g) 2NH3 (g) ΔH=-92.2kJ·mol-1
2NH3 (g) ΔH=-92.2kJ·mol-1
(4)下列事实中,不能说明上述可逆反应已经达到平衡的是 。
① N2、H2、NH3的体积分数不再改变;
② 单位时间内生成2n mol NH3的同时生成3n mol H2;
③ 单位时间内生成3n mol N—H键的同时生成n mol N≡N;
④ 用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2;
⑤ 混合气体的平均摩尔质量不再改变;
⑥ 混合气体的总物质的量不再改变。
(5)已知合成氨反应在某温度下2.00L的密闭容器中反应,测得如下数据:
根据表中数据计算:
①反应进行到2小时时放出的热量为 kJ。
②0~1小时内N2的平均反应速率 mol·L-1·h-1。
③此条件下该反应的化学平衡常数K== (保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1 mol,化学平衡向 方向移动(填“正反应”或“逆反应”或“不移动”。)