摘要:28.答案:B.D. (3)①联合制碱法或侯德榜制碱法 化肥或电解液或焊药等 ②NH3+CO2+H2O+NaCl→NH4Cl+NaHCO3↓ 或NH3+CO2+H2O→NH4HCO3. NH4HCO3+NaCl→NaHCO3↓+NH4Cl ③CO2 ④I, 过滤 ⑤ NaCl.NH4Cl.NH4HCO3 a.c 解析:(1)由信息知:杜绝污染源符合“绿色化学 观念. (2)化工厂应建在水资源丰富和交通方便的远离城市的郊区.不宜建在人口稠密的居民区. (3)侯德榜制碱法的原理是利用一定条件下NaHCO3溶解度相对较小的特点.在饱和食盐水中先后通入NH3.CO2.获得NaHCO3后再煅烧生成Na2CO3. ①上述生产纯碱的方法称联合制碱法或侯德榜制碱法.其副产品NH4Cl可做化肥或电解液或焊药等 ②沉淀池中发生的反应是: NH3+CO2+H2O→NH4HCO3.NH4HCO3+NaCl→NaHCO3↓+NH4Cl ③上述流程中煅烧炉内的NaHCO3分解产生的CO2可循环使用.故X物质是CO2. ④母液中含有氯化钠通过I循环使用.提高氯化钠的利用率,从沉淀池中得到NaHCO3沉淀需过滤. ⑤ NaHCO3大部分析出后.母液中仍溶有部分Na+.HCO3-.NH4+和Cl-.向母液中通氨气时发生反应HCO3-+NH3→NH4++CO32-.增大了NH4+的浓度.使NaHCO3转化为Na2CO3.NH4Cl更多地析出.也提高了其纯度.
网址:http://m.1010jiajiao.com/timu3_id_45009[举报]
 已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )
已知某温度时CH3COOH的电离平衡常数为K.该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中不正确的是( )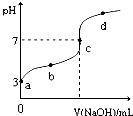 已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )
已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( )| A、a点表示的溶液中由水电离出的H+浓度为1.0×10-3mol?L-1 | ||
| B、b点表示的溶液c(CH3COO-)<c(Na+) | ||
| C、c点表示CH3COOH和NaOH恰好反应完全 | ||
D、b、d点表示的溶液中
|
现有A、B、C、D四种钠的化合物,除一种为淡黄色外,其余均为白色粉末,已知四种物质可分别发生如下反应:
①A+C→B+H2O
②D+CO2→B+O2
③D+H2O→C+O2↑
④A→B+H2O+CO2
则A、B、C、D四种物质分别为( )
①A+C→B+H2O
②D+CO2→B+O2
③D+H2O→C+O2↑
④A→B+H2O+CO2
则A、B、C、D四种物质分别为( )
| A、NaHCO3、Na2CO3、NaOH、Na2O2 | B、Na2CO3、NaHCO3、NaOH、Na2O2 | C、NaHCO3、NaOH、Na2CO3、Na2O2 | D、NaOH、Na2CO3、NaHCO3、Na2O2 |
短周期主族元素A、B、C、D的原子序数依次增大.已知:A、C的原子序数的差为8,A、B、C三种元素原子的最外层电子数之和为15,B原子的最外层电子数等于A原子最外层电子数的一半.下列叙述中正确的是( )
| A、原子半径:A<D<B<C | B、最简单氢化物的稳定性:C>D | C、A与C形成的化合物溶于水所得溶液显碱性 | D、B与D形成的化合物溶于水所得溶液显酸性 |
化合物A是由三种元素组成的一种矿石的主要成分.A在氧气中高温煅烧生成B、C、D,B、D、K均为红色固体.E、K、J是三种常见金属,其中E元素是地壳中含量景高的金属元素,N可用作净水剂,N溶液中加入BaCl2溶液生成不溶于稀硝酸的白色沉淀,M溶液呈蓝色(部分反应物或生成物已略去).
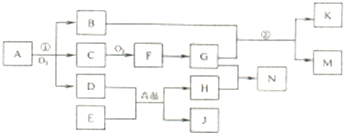
回答下列问题:
(1)写出化学式:E
(2)用离子方程式表示N净水的原理
(3)反应①中得到的B、C、D三种物质的物质的量之比为1:4:1,A的相对分子质量为184,则A的化学式为
(4)写出B与G的稀溶液发生反应②的离子方程式
查看习题详情和答案>>

回答下列问题:
(1)写出化学式:E
Al
Al
、GH2SO4
H2SO4
.(2)用离子方程式表示N净水的原理
Al3++3H2O?2Al(OH)3(胶体)+3H+
Al3++3H2O?2Al(OH)3(胶体)+3H+
.(3)反应①中得到的B、C、D三种物质的物质的量之比为1:4:1,A的相对分子质量为184,则A的化学式为
CuFeS2
CuFeS2
.(4)写出B与G的稀溶液发生反应②的离子方程式
Cu2O+2H+=Cu2++Cu+H2O
Cu2O+2H+=Cu2++Cu+H2O
.