网址:http://m.1010jiajiao.com/timu3_id_44922[举报]

(1)装置A用来制取氧气,写出相应的化学方程式
| ||
| ||
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为
| ||
| ||
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是
(4)工业上利用2SO2(g)+O2(g)═2SO3(g)反应制备SO3,下表是在一定条件下测定的SO2的转化率,根据表格中提供的数据,请选择工业利用该反应制备SO3的温度与压强
| 压强/Mpa 转化率 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
①A中盛放的试剂是
②B中盛放98.3%浓硫酸的作用是
③C中盛放的试剂是
(6)在硫酸工业的尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可采用过量氨气吸收,反应的离子方程式是
|
(1)装置A用来制取氧气,写出相应的化学方程式__________________________;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为![]() ,在该反应中____________做氧化剂;若消耗了
,在该反应中____________做氧化剂;若消耗了![]() 有_______________mol电子发生了转移;
有_______________mol电子发生了转移;
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是_______________________________________________;
(4)如果D装置的温度是400℃~500℃,在常压下生成![]() ,可放出
,可放出![]() 的热量,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_ ____________________________。
的热量,请写出该反应的热化学方程式________________________________________;并回答在工业中不采取加压措施的原因_ ____________________________。
某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据图回答问题:
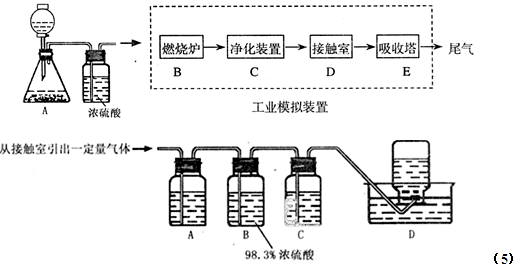
(1)装置A用来制取氧气,写出相应的化学方程式______;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为______;现有含FeS260%的黄铁矿100t,如果在煅烧的过程中,S损失了18%,则可生产质量分数为98%的硫酸______吨.
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是______;
(4)工业上利用2SO2(g)+O2(g)═2SO3(g)反应制备SO3,下表是在一定条件下测定的SO2的转化率,根据表格中提供的数据,请选择工业利用该反应制备SO3的温度与压强______.
| 压强/Mpa 转化率 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
①A中盛放的试剂是______;
②B中盛放98.3%浓硫酸的作用是______,乙同学提出可用饱和NaHSO3溶液代替98.3%的浓硫酸,请你判断乙同学的方案______ (填“可行”或“不可行”),说明理由______;
③C中盛放的试剂是______,其作用是______;
(6)在硫酸工业的尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可采用过量氨气吸收,反应的离子方程式是______. 查看习题详情和答案>>
某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据要求回答问题:
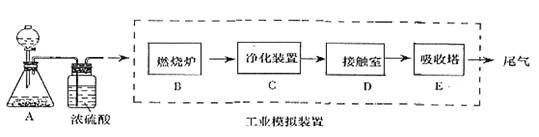
(1)装置A用来制取氧气,写出相应的化学方程式__________________________;
(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为 ,在该反应中____________做氧化剂,若消耗了12gFeS2有_________mol电子发生了转移;
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是___________________________________;
(4)如果D装置的温度是400℃~500℃,回答在工业中不采取加压措施的原因_______
______________________________________ ;
(5)为检验从接触室出来的气体成分,甲同学设计如下实验:
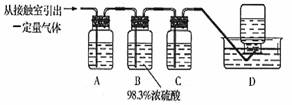
①A中盛放的试剂是____________________;
②B中盛放98.3%浓硫酸的作用是_______________________________________,乙同学提出可用饱和NaHSO3溶液代替98.3%的浓硫酸,请你判断乙同学的方案_ _____(填“可行”或“不可行”)说明理由___________ ;
③C中盛放的试剂是________________,其作用是 。
查看习题详情和答案>>某化学兴趣小组的同学为模拟工业制造硫酸的生产过程,设计了如图所示的装置,请根据根据回答问题:
(1)装置A用来制取氧气,写出相应的化学方程式 ;

(2)燃烧炉内放一定量黄铁矿粉末,在高温条件下和A装置制出的氧气充分反应,其化学方程式为 ;现有含FeS260%的黄铁矿100t,如果在煅烧的过程中,S损失了18%,则可生产质量分数为98%的硫酸 吨。
(3)C装置为净化装置,若无该装置,将混合气体直接通入D装置,除对设备有腐蚀外,还会造成的后果是 ;
(4)工业上利用2SO2(g)+O2(g)====2SO3(g)反应制备SO3,下表是在一定条件下测定的SO2的转化率,根据表格中提供的数据,请选择工业利用该反应制备SO3的温度与压强 。
|
转化率 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
(5)为检验从接触室出来的气体成分,甲同学设计如下实验:

①A中盛放的试剂是 ;
②B中盛放98.3%浓硫酸的作用是 ,乙同学提出可用饱和NaHSO3溶液代替98.3%的浓硫酸,请你判断乙同学的方案 (填“可行”或“不可行”说明理由 ;
③C中盛放的试剂是 ,其作用是 ;
(6)在硫酸工业的尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可采用过量氨不吸收,反应的离子方程式是 。
查看习题详情和答案>>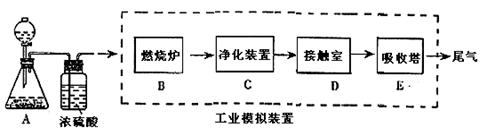
 压强/Mpa
压强/Mpa