摘要:1某温度下.O.1 moL/L醋酸溶液的pH=3.将该温度下O.2 moL/L醋酸溶液和O.2 mol/L醋酸钠溶液等体积混合后.混合液的pH=4.7.下列说法正确的是( ) A.该温度下.O.01 mol/L醋酸溶液的pH=4 B.该温度下.用PH=3醋酸和PH=4醋酸分别完全中和等体积等浓度的NaOH溶液.消耗两醋酸的体积比为 <l:10 C.该温度下.0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后.混合液的pH < 4.7 D.该温度下.0.2 mol/L盐酸溶液和0.4 mol/L醋酸钠溶液等体积混合后.混合液的pH = 4.7 2.在某未知溶液中加入醋酸钠晶体后测得溶液中c(Na+)与C(CH3COO-)之比等于1:1. 对原来未知溶液的判断正确的是( ) A.可能是强酸溶液 B.可能是强碱溶液 C.可能是中性溶液 D.难以确定
网址:http://m.1010jiajiao.com/timu3_id_44878[举报]
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤。
(1)某温度下,SO2(g)+1/2O2(g) SO3(g)△H=-98 kJ/mol。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出196kJ的热量,该温度下的平衡常数K=_________。
SO3(g)△H=-98 kJ/mol。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出196kJ的热量,该温度下的平衡常数K=_________。
(2)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)
 2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是_______(填字母)。
2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是_______(填字母)。
A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 mol O2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
F.移动活塞压缩气体
(3)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:____________
(1)某温度下,SO2(g)+1/2O2(g)
 SO3(g)△H=-98 kJ/mol。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出196kJ的热量,该温度下的平衡常数K=_________。
SO3(g)△H=-98 kJ/mol。开始时在100 L的密闭容器中加入4.0 mol SO2(g)和10.0 mol O2(g),当反应达到平衡时共放出196kJ的热量,该温度下的平衡常数K=_________。 (2)一定条件下,向一带活塞的密闭容器中充入2 mol SO2和1 mol O2,发生下列反应:2SO2(g)+O2(g)
 2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是_______(填字母)。
2SO3(g),达到平衡后,改变下述条件,SO2、O2、SO3的平衡浓度都比原来增大的是_______(填字母)。 A.保持温度和容器体积不变,充入2 mol SO3
B.保持温度和容器体积不变,充入2 mol N2
C.保持温度和容器体积不变,充入0.5 mol SO2和0.25 mol O2
D.保持温度和容器内压强不变,充入1 mol SO3
E.升高温度
F.移动活塞压缩气体
(3)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:____________

(4)常温时,BaSO4的Ksp=1.08×10-10,现将等体积的BaCl2溶液与2.0×10-3mol/L的Na2SO4溶液混合。若要 生成BaSO4沉淀,BaCl2溶液的最小浓度为___________。
(5)下列关于2SO2(g)+O2(g) 2SO3(g)反应的图像中,正确的是______________。
2SO3(g)反应的图像中,正确的是______________。
(5)下列关于2SO2(g)+O2(g)
 2SO3(g)反应的图像中,正确的是______________。
2SO3(g)反应的图像中,正确的是______________。 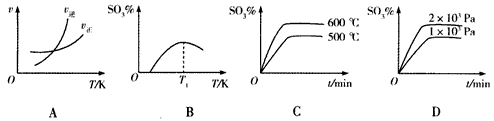
(6)SO2既有氧化性又有还原性,还有漂白性。将SO2通入酸性KMnO4溶液中,酸性KMnO4溶液褪色,SO2表现______性,其中氧化剂和还原剂的物质的量之比为_______(已知:KMnO4的还原产物为Mn2+)。
查看习题详情和答案>>
亚憐酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3.
(1)PCl3水解可制取亚磷酸:PCl3+32O═H3PO3+______.
(2)H3PO3溶液中存在电离平衡:H3PO3?H++H2PO3-.
①某温度下,O.1Omol.L-1 的 H3PO3 溶液 pH=1.6,即溶液中 c(H+)=2.5x 10-2 mol.L-1.求该温度下上述电离平衡的平衡常数K,写出计算过程.
(H3PO3的第二步电离忽略不计,结果保留两位有效数字.)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7 (填“>”、“=”或“<”).
(3)亚磷酸具有强还原性,可使碘水褪色.该反应的化学方程式为______
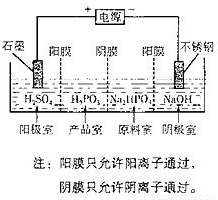
(4)电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如图:
①阴极的电极反应式为______
②产品室中反应的离子方程式为______.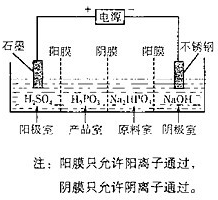
查看习题详情和答案>>
(1)PCl3水解可制取亚磷酸:PCl3+32O═H3PO3+______.
(2)H3PO3溶液中存在电离平衡:H3PO3?H++H2PO3-.
①某温度下,O.1Omol.L-1 的 H3PO3 溶液 pH=1.6,即溶液中 c(H+)=2.5x 10-2 mol.L-1.求该温度下上述电离平衡的平衡常数K,写出计算过程.
(H3PO3的第二步电离忽略不计,结果保留两位有效数字.)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7 (填“>”、“=”或“<”).
(3)亚磷酸具有强还原性,可使碘水褪色.该反应的化学方程式为______
(4)电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如图:
①阴极的电极反应式为______
②产品室中反应的离子方程式为______.

亚憐酸(H3PO3)是二元酸,与足量NaOH溶液反应生成Na2HPO3.
(1)PCl3水解可制取亚磷酸:PCl3+32O═H3PO3+______.
(2)H3PO3溶液中存在电离平衡:H3PO3?H++H2PO3-.
①某温度下,O.1Omol.L-1 的 H3PO3 溶液 pH=1.6,即溶液中 c(H+)=2.5x 10-2 mol.L-1.求该温度下上述电离平衡的平衡常数K,写出计算过程.
(H3PO3的第二步电离忽略不计,结果保留两位有效数字.)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7 (填“>”、“=”或“<”).
(3)亚磷酸具有强还原性,可使碘水褪色.该反应的化学方程式为______
(4)电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如图:
①阴极的电极反应式为______
②产品室中反应的离子方程式为______.
 查看习题详情和答案>>
查看习题详情和答案>>
(1)PCl3水解可制取亚磷酸:PCl3+32O═H3PO3+______.
(2)H3PO3溶液中存在电离平衡:H3PO3?H++H2PO3-.
①某温度下,O.1Omol.L-1 的 H3PO3 溶液 pH=1.6,即溶液中 c(H+)=2.5x 10-2 mol.L-1.求该温度下上述电离平衡的平衡常数K,写出计算过程.
(H3PO3的第二步电离忽略不计,结果保留两位有效数字.)
②根据H3PO3的性质可推测Na2HPO3稀溶液的pH______7 (填“>”、“=”或“<”).
(3)亚磷酸具有强还原性,可使碘水褪色.该反应的化学方程式为______
(4)电解Na2HPO3溶液也可得到亚鱗酸,装置示意图如图:
①阴极的电极反应式为______
②产品室中反应的离子方程式为______.
 查看习题详情和答案>>
查看习题详情和答案>>
二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚(CH3OCH3).
请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是:
a.压缩体积 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚(CH3OCH3)
(3)已知反应②:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小比较:v正
②该反应的平衡常数的表达式为K=
温度升高,该反应的平衡常数K
查看习题详情和答案>>
请回答下列问题:
(1)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:
Na2CO3+H2S═NaHCO3+NaHS
Na2CO3+H2S═NaHCO3+NaHS
(2)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.3kJ?mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)的△H=
-246.4kJ?mol-1
-246.4kJ?mol-1
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是:
a、c、e
a、c、e
(填字母代号).a.压缩体积 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚(CH3OCH3)
(3)已知反应②:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol?L-1) | 0.40 | 0.6 | 0.6 |
>
>
v逆 (填“>”、“<”或“=”).②该反应的平衡常数的表达式为K=
| c(CH3OCH3)c(H2O) |
| c2(CH3OH) |
| c(CH3OCH3)c(H2O) |
| c2(CH3OH) |
减小
减小
(填“增大”、“减小”或“不变”).