摘要:下列叙述不正确的是:( ) A.金属钠跟乙醇的反应比跟水的反应平缓.说明乙醇分子中的氢原子不如水分子中的氢原子活泼 B.在相同条件下.硫酸跟相同浓度的Na2S2O3溶液反应.出现浑浊快的硫酸浓度大 C.在相同条件下.NaX溶液的pH比NaY溶液的大.说明元素X比元素Y的非金属性强 D.在相同温度下.BaSO4比MgSO4难溶于水.说明Ba的金属性比Mg的金属性弱
网址:http://m.1010jiajiao.com/timu3_id_44424[举报]
在氮的化合物中,有一类盐叫亚硝酸盐.如亚硝酸钠(NaNO2)等.它们广泛用于印染、漂白等行业,在建筑行业用作防冻剂,在食品工业作防腐剂和增色剂;它是一种潜在致癌物质,过量或长期食用对人产生危害,由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生过被误当食盐食用的事件.
某同学查阅有关资料,了解到以下相关信息:
亚硝酸及亚硝酸盐的资料:
(1)HNO2是一种弱酸(比醋酸略强),且不稳定,易分解生成NO和NO2
(2)HNO2能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把氧化成I2
(3)AgNO2种难溶于水易溶于酸的化合物
(4)NaNO2制备:
2NaOH+NO+NO2═2NaNO2+H2O
2NO2+2NaOH═NaNO3+NaNO2+H2O
2NaNO3
2NaNO2+O2↑
试回答下列问题:
(1)人体正常的血红蛋白中应含Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是 .
A.亚硝酸盐是还原剂 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被还原
(2)下列方法中,不能用来区别NaNO2和NaCl的是 .
A.测定这两种溶液的pH
B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI淀粉试液来区别
D.分别在这两种溶液中滴加甲基橙
(3)为了测定某样品中NaNO2的含量,可以使用标准KMnO4溶液进行滴定,试回答:
①KMnO4溶液在滴定过程中作 (填“氧化剂”“还原剂”),该滴定过程 (填“要”或“不要”)另加指示剂.
②若滴定终点读数时目光俯视,则所得结果 (填“偏大”“偏小”“无影响”).
(4)某同学在家中欲进行鉴别NaCl与NaNO2的实验,但他家中只有浓醋酸,请问该实验能否成功?说明理由.
(5)现有氮的三种常见氧化物组成的混和气体44.8L(体积已换算成标准状态),其中N2O4、NO体积分数都为20%.
①将该气体通入适量的NaOH溶液中恰好反应,则溶液中NaNO2的质量是 g;
②反应后的溶液蒸干灼烧则NaNO2物质的量 mol.
查看习题详情和答案>>
某同学查阅有关资料,了解到以下相关信息:
亚硝酸及亚硝酸盐的资料:
(1)HNO2是一种弱酸(比醋酸略强),且不稳定,易分解生成NO和NO2
(2)HNO2能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把氧化成I2
(3)AgNO2种难溶于水易溶于酸的化合物
(4)NaNO2制备:
2NaOH+NO+NO2═2NaNO2+H2O
2NO2+2NaOH═NaNO3+NaNO2+H2O
2NaNO3
| ||
试回答下列问题:
(1)人体正常的血红蛋白中应含Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是
A.亚硝酸盐是还原剂 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被还原
(2)下列方法中,不能用来区别NaNO2和NaCl的是
A.测定这两种溶液的pH
B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI淀粉试液来区别
D.分别在这两种溶液中滴加甲基橙
(3)为了测定某样品中NaNO2的含量,可以使用标准KMnO4溶液进行滴定,试回答:
①KMnO4溶液在滴定过程中作
②若滴定终点读数时目光俯视,则所得结果
(4)某同学在家中欲进行鉴别NaCl与NaNO2的实验,但他家中只有浓醋酸,请问该实验能否成功?说明理由.
(5)现有氮的三种常见氧化物组成的混和气体44.8L(体积已换算成标准状态),其中N2O4、NO体积分数都为20%.
①将该气体通入适量的NaOH溶液中恰好反应,则溶液中NaNO2的质量是
②反应后的溶液蒸干灼烧则NaNO2物质的量
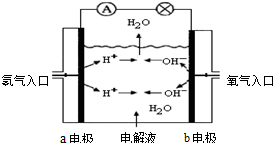 图为氢氧燃料电池原理示意图,按照此图的提示,回答以下问题:
图为氢氧燃料电池原理示意图,按照此图的提示,回答以下问题:(1)下列叙述不正确的是
B
B
A a电极是负极
B b电极的电极反应为:4OH--4e-=2H2O+O2↑
C 氢氧燃料电池是一种具有应用前景的绿色电源
D 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)若电解质溶液为KOH溶液,则电极反应式为:a极
2H2-4e-+4OH-=4H2O
2H2-4e-+4OH-=4H2O
b极O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
(3)若电解质溶液为稀H2SO4,则电极反应式为:a极
2H2-4e-=4H+
2H2-4e-=4H+
b极O2+4H++4e-=2H2O
O2+4H++4e-=2H2O
.水的电离平衡为H2O 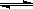 H+﹢OH-,△H>0,下列叙述不正确的是
H+﹢OH-,△H>0,下列叙述不正确的是
A.将水加热,pH减小
B.恒温下,向水中加入少量固体KOH,Kw不变
C.向水中滴入稀醋酸,c(H+)增大
D.向水中加入少量固体NaClO,平衡逆向移动
查看习题详情和答案>>
从化学角度分析,下列叙述不正确的是:
| A.化学是在分子原子水平上认识物质,所以通过化学手段可以识别、改造和创造分子 |
| B.化学是以实验为基础的一门学科,定量研究方法是化学发展为一门学科的重要标志 |
| C.绿色化学是指以绿色植物为原料来源的现代新型化学工业 |
| D.化学反应中的能量变化常用焓变(△H)来表示,△H=H(反应产物)-H(反应物) |