摘要:24]. (1)正六价的高铁酸盐是一种强氧化剂.在酸性溶液中其氧化还原电极电位高达1.9V,在碱性溶液中其氧化还原电极电位也有0.9V.因此被广泛地用于代替高氯酸盐净化水和氧化生成有机化合物的反应.由高铁酸钡与锌组成的碱性干电池.其理论电压超过2.0V.分别写出上述3个反应的方程式. (2)高铁酸钡可以电解法进行制备:以铂为阴极.铁为阳极.以饱和NaOH/Ba(OH)2溶液为电解液.以某阳离子交换膜为隔膜.此反应在惰性气体保护下进行.写出电极反应和总反应方程式, (3)MnO2的掺入可降低高铁酸盐电池的放电电压.其机理是由于正极掺杂的MnO2也能发生放电反应.其放电产物Mn2O3可以与FeO42-发生化学反应.原来紫黑色粉末中开始出现铁锈色.生成的MnO2可以催化FeO42-发生还原反应.使得其还原电位向MnO2的还原电位靠拢.放电电压降低.请写出上面的所有反应式. (4)高铁酸盐的浓度是通过铬酸盐氧化法进行确定的.在浓碱溶液中.过量的三价铬盐定量还原高铁酸盐而自身被氧化为铬酸盐(CrO42-).所生成的铬酸盐经酸化变为重铬酸盐(Cr2O72-).再用标准的Fe2+溶液滴定. (1)写出上述反应方程式, (2)指出FeO42-与Fe2+的计量关系.
网址:http://m.1010jiajiao.com/timu3_id_435364[举报]
(2010?广州一模)新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定.工业上制备K2FeO4的常用方法有两种.
方法Ⅰ:次氯酸盐氧化法,工艺流程如图.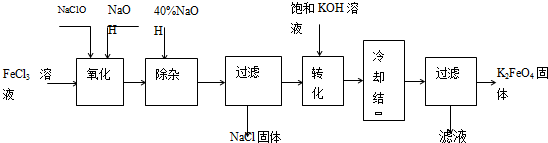
(1)完成“氧化”过程中反应的化学方程式:
(2)“转化”过程中发生反应的化学方程式为
(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用
方法Ⅱ:电解法.以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH.
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为
查看习题详情和答案>>
方法Ⅰ:次氯酸盐氧化法,工艺流程如图.

(1)完成“氧化”过程中反应的化学方程式:
2
2
FeCl3+10
10
NaOH+3
3
NaClO→2
2
Na2FeO4+9NaCl
9NaCl
d+5H2O
5H2O
d其中氧化剂是NaClO
NaClO
(填化学式).(2)“转化”过程中发生反应的化学方程式为
Na2FeO4+2KOH=K2FeO4+2NaOH
Na2FeO4+2KOH=K2FeO4+2NaOH
.(3)上述工艺得到的高铁酸钾常含有杂质,可用重结晶法提纯,操作是:将粗产品用
稀KOH溶液
稀KOH溶液
溶解,然后再加入饱和KOH溶液,冷却结晶,过滤
再加入饱和KOH溶液,冷却结晶,过滤
.方法Ⅱ:电解法.以铁为阳极电解氢氧化钠溶液,然后在阳极液中加入KOH.
(4)电解时阳极发生反应生成FeO42-,该电极反应方程式为
Fe+8OH--6e-=FeO42-+4H2O
Fe+8OH--6e-=FeO42-+4H2O
.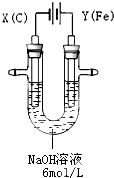 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.Ⅰ.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
(1)电解过程中,X极是
阴
阴
极,电极反应是2H++2e-=H2↑
2H++2e-=H2↑
.(2)电解过程中,Y极放电的有
Fe和OH-
Fe和OH-
.(3)生成高铁酸根(FeO42-)的电极反应是
Fe+8OH--6e-=FeO42-+4H2O
Fe+8OH--6e-=FeO42-+4H2O
.Ⅱ.若用不同种电池作为上述实验的电源,请分析电池反应.
(1)铅蓄电池总的化学方程式为:Pb+PbO2+2H2SO4
| 充电 | 放电 |
PbSO4+2H2O-2e-=PbO2+SO42-+4H+
PbSO4+2H2O-2e-=PbO2+SO42-+4H+
.(2)镍镉碱性充电电池在放电时,其两极的电极反应如下:
正极:2NiOOH+2H2O+2e-=2Ni(OH)2+2OH-
负极:Cd+2OH--2e-=Cd(OH)2
则它在放电时的总反应的化学方程式为
Cd+2NiOOH+2H2O=Cd(OH)2+2Ni(OH)2
Cd+2NiOOH+2H2O=Cd(OH)2+2Ni(OH)2
.(3)肼(N2H4)是一种可燃性液体,可用作火箭燃料.已知在25℃、101kPa时,32.0g N2H4在氧气中完全燃烧生成氮气和液态水,放出624kJ的热量,则N2H4完全燃烧的热化学方程式是
N2H4(1)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol
N2H4(1)+O2(g)=N2(g)+2H2O(l)△H=-624kJ/mol
;肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,放电时负极的电极反应是N2H4+4OH--4e-=4H2O+N2↑
N2H4+4OH--4e-=4H2O+N2↑
.(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐,电池总反应方程式为:C3H8+5O2=3CO2+4H2O.
写出该电池正极的电极反应:
O2+2CO2+4e-=2CO32-
O2+2CO2+4e-=2CO32-
.(5)当制备相同物质的量的高铁酸钾时,理论上,上述四种电池中分别消耗的Pb、Cd、肼、丙烷的物质的量之比是
10:10:5:1
10:10:5:1
.高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性.
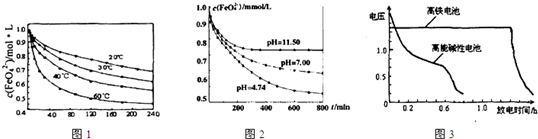
(1)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0×10-3mol?L-的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)随时间变化的结果如图1所示.
该实验的目的是
(2)将适量K2FeO4分别溶解于pH=4.74、7.00、11.50的水溶液中,配制成c(FeO42-)=1.0×10-3 mol?L-的试样,静置,考察不同初始pH的水溶液对K2FeO4某种性质的影响,其变化图象见图2,800min时,在pH=11.50的溶液中,K2FeO4的浓度比在pH=4.74的溶液中高,主要原因是
(3)电解法是工业上制备K2FeO4的一种方法.以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH,即在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明
(4)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成高铁电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ,则该电池总反应的离子方程式为
查看习题详情和答案>>

(1)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0×10-3mol?L-的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)随时间变化的结果如图1所示.
该实验的目的是
探究温度对FeO42-影响(温度越高,高铁酸钾越不稳定)
探究温度对FeO42-影响(温度越高,高铁酸钾越不稳定)
;FeO42-发生反应的△H>
>
0(填“>”“<”或“=”)(2)将适量K2FeO4分别溶解于pH=4.74、7.00、11.50的水溶液中,配制成c(FeO42-)=1.0×10-3 mol?L-的试样,静置,考察不同初始pH的水溶液对K2FeO4某种性质的影响,其变化图象见图2,800min时,在pH=11.50的溶液中,K2FeO4的浓度比在pH=4.74的溶液中高,主要原因是
pH=11.50时溶液中OHˉ离子浓度大,不利于K2FeO4与水的反应正向进行
pH=11.50时溶液中OHˉ离子浓度大,不利于K2FeO4与水的反应正向进行
.(3)电解法是工业上制备K2FeO4的一种方法.以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH,即在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明
同温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小
同温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小
.电解时阳极发生反应生成FeO42-,该电极反应式为Fe+8OHˉ-6eˉ=FeO42-+4H2O
Fe+8OHˉ-6eˉ=FeO42-+4H2O
.(4)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成高铁电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ,则该电池总反应的离子方程式为
3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OHˉ
3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OHˉ
.如图3为高铁酸钾电池和高能碱性电池放电曲线,由此可得出的高铁酸钾电池的优点有放电时间长
放电时间长
、工作电压稳定
工作电压稳定
.(2011?泰州二模)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染.已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:

(1)在农业生产中,滤液1可用作
(2)上述氧化过程中,发生反应的离子方程式是:
(3)结晶过程中加入浓KOH溶液的作用是:
(4)某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为
(5)实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如下图1、图2所示.为了获取更多的高铁酸钾,铁盐的质量分数应控制在

查看习题详情和答案>>

(1)在农业生产中,滤液1可用作
复合肥(或化肥)
复合肥(或化肥)
.(2)上述氧化过程中,发生反应的离子方程式是:
2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
,控制反应温度30℃以下的原因是:防止生成的K2FeO4发生分解
防止生成的K2FeO4发生分解
.(3)结晶过程中加入浓KOH溶液的作用是:
增大K+浓度,促进K2FeO4晶体析出
增大K+浓度,促进K2FeO4晶体析出
.(4)某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为
11:3
11:3
.(5)实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如下图1、图2所示.为了获取更多的高铁酸钾,铁盐的质量分数应控制在
30%
30%
附近、反应时间应控制在60min
60min
.
 电解高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于废水和生活用水的处理.从环境保护的角度看,制备高铁酸盐较好的方法为电解法:Fe+2NaOH+2H2O═Na2FeO4+H2↑.
电解高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于废水和生活用水的处理.从环境保护的角度看,制备高铁酸盐较好的方法为电解法:Fe+2NaOH+2H2O═Na2FeO4+H2↑.(1)采用铁片作阳极,NaOH溶液为电解质溶液,电解制备高铁酸钠,其电流效率可达到40%.写出阳极的电极反应式:
Fe-6e-+8OH-═FeO42-+4H2O
Fe-6e-+8OH-═FeO42-+4H2O
.(2)铁丝网电极是更理想的阳极材料,相同条件下,可将电流效率提高至70%以上,原因是
铁丝网的接触面积更大
铁丝网的接触面积更大
.研究亦发现,铁电极在某一电压范围内会生成Fe2O3膜而“钝化”,钝化的原因用反应式表示为因为铁电极上发生析氧反应4OH--4e-═O2↑+2H2O,氧气将铁氧化而得到氧化铁膜
因为铁电极上发生析氧反应4OH--4e-═O2↑+2H2O,氧气将铁氧化而得到氧化铁膜
.(3)FeO42-易与水反应生成絮状氢氧化铁,也会影响高铁酸盐的产率.若以铁丝网为阳极,在中间环节(对应图1中4h后)过滤掉氢氧化铁,合成过程中FeO42-浓度以及电流效率随时间的变化如图1中实线所示(图中曲线是每隔1h测得的数据).图中虚线部分对应于没有过滤氢氧化铁而连续电解的情况.下列判断正确的是
ACD
ACD
A.过滤掉氢氧化铁有利于获得较高浓度的高铁酸盐溶液
B.过滤掉氢氧化铁对电流效率影响不大
C.实验表明氢氧化铁的存在影响高铁酸盐浓度的增加
D.实验表明不过滤掉氢氧化铁,6h后电流效率几乎为0
(4)碱性条件下,高铁酸盐的稳定性与温度有关(如图2).随温度升高,高铁酸盐产率先增大后减小的原因是
升温电解一方面加快了高铁酸盐的生成速率,另一方面又加速FeO42-的分解
升温电解一方面加快了高铁酸盐的生成速率,另一方面又加速FeO42-的分解
.
(5)人们还对用铁的氧化物作电极制备高铁酸盐进行了研究,例如以磁铁矿多孔电极制备高铁酸盐,该研究方向的价值在于
BCD
BCD
A.将1mol Fe3O4氧化成高铁酸盐需10/3mol电子,可提高电流效率
B.以铁的氧化物为电极,可以实现变废(Fe3O4或铁锈)为宝(高铁酸盐)
C.自然界几乎没有铁单质,而有大量磁铁矿,该方法的原料来源广泛
D.磁铁矿作为多孔电极不会出现钝化现象.