摘要: 某分子X12的构型是正多面体.每个X原子与相邻的5个X原子等距离形成共价键.每个面都是正三角形.X12分子中共有 个共价键.正多面体的面数是 .
网址:http://m.1010jiajiao.com/timu3_id_435028[举报]
下列叙述中正确的是
[ ]
A.2s轨道可以和3p轨道形成sp2杂化轨道
B.烯烃中的碳碳双键由一个σ键和一个π键组成
C.苯分子中存在碳碳双键
D.sp3杂化轨道的构型是正四面体形
查看习题详情和答案>>
B.烯烃中的碳碳双键由一个σ键和一个π键组成
C.苯分子中存在碳碳双键
D.sp3杂化轨道的构型是正四面体形
| |||||||||||||||
Q、R、X、Y、Z 为前 18 号元素中的五种,Q 的低价氧化物与 X 单质分子的电子总数相等,R 与 Q 同族,X、Y与Z不同族,Y 和 Z 的阴离子与 Ar 原子的电子结构相同且 Y 的原子序数小于 Z.
(1)Q 的最高价氧化物,其固态俗名叫
(2)R 的氢化物分子的空间构型是
(3)X 的常见氢化物的空构型是
 ;
;
(4)Q 分别与 Y、Z 形成的化合物的化学式是
查看习题详情和答案>>
(1)Q 的最高价氧化物,其固态俗名叫
干冰
干冰
;(2)R 的氢化物分子的空间构型是
正四面体
正四面体
,它与 X 形成的化合物可作为一种重要的陶瓷材料,其化学式是Si3N4
Si3N4
;(3)X 的常见氢化物的空构型是
三角锥形
三角锥形
;它的另一氢化物 X2H4 是一种火箭燃料的成分,其电子式是

(4)Q 分别与 Y、Z 形成的化合物的化学式是
CS2
CS2
和CCl4
CCl4
;Q和 Y 形成的化合物分子的结构式是S═C═S
S═C═S
,属于共价
共价
化合物(填“离子”或“共价”),非极性
非极性
分子(填“极性”或“非极性”)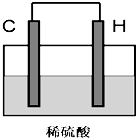 下表是元素周期表的前三周期:
下表是元素周期表的前三周期:| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 一 | A | |||||||
| 二 | B | C | D | E | F | |||
| 三 | G | H | I | J |
(1)写出下列元素的元素的符号:F
F
F
、JAr
Ar
.(2)G元素与E元素形成的化合物的化学式是
Na2O
Na2O
、Na2O2
Na2O2
,它们都是离子
离子
(填“离子”或“共价”)化合物.(3)表格中十种元素的最高氧化物对应的水化物中,酸性最强的是
HClO4
HClO4
,属于两性氢氧化物的是Al(OH)3
Al(OH)3
(用化合物的化学式表示).(4)只含有A、C两种元素的化合物称为
烃
烃
,这些化合物中:①相对分子质量最小的是
CH4
CH4
,该化合物的分子空间构型是正四面体
正四面体
;②分子中含有双键,但原子数最少的是
CH2=CH2
CH2=CH2
,它与HCl反应的化学方程式为CH2=CH2+HCl→CH3CH2Cl
CH2=CH2+HCl→CH3CH2Cl
;(5)将H单质与C的一种单质(导体)按如图装置连接,该装置称为
原电池
原电池
.其中C极为正极
正极
,(填正负极)并写出该电极反应式为:2H++2e-=H2↑
2H++2e-=H2↑
.电子流动方向H流向C
H流向C
.I.下列分子中,属于非极性分子的是
A、SO2 B、BeCl2 C、BBr3 D、COCl2
II.铜(Cu)是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:
(1)Cu+基态核外电子排布式为
(2)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为:
(3)SO42-的立体构型是
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为
查看习题详情和答案>>
BC
BC
A、SO2 B、BeCl2 C、BBr3 D、COCl2
II.铜(Cu)是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:
(1)Cu+基态核外电子排布式为
1s22s22p63s23p63d10
1s22s22p63s23p63d10
.(2)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为:
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
;CuSO4粉末常用来检验一些有机物中的微量水分,其原因是
| ||
白色无水硫酸铜可与水结合生成蓝色的CuSO4?5H2O,显示水合铜离子特征蓝色
白色无水硫酸铜可与水结合生成蓝色的CuSO4?5H2O,显示水合铜离子特征蓝色
;(3)SO42-的立体构型是
正四面体
正四面体
,其中S原子的杂化轨道类型是sp3
sp3
;(4)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为
3:1
3:1
;该晶体中,粒子之间的作用力是金属键
金属键
;(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为
H8AuCu3
H8AuCu3
.