网址:http://m.1010jiajiao.com/timu3_id_434944[举报]
下列化合物:
①HCl
②NaOH
③CH3COOH
④NH3·H2O
⑤CH3COONa
⑥NH4Cl
(1)属于弱电解质的是________(填序号),溶液呈酸性的有________(填序号).
(2)25℃时,0.10 mol/LCH3COONa溶液pH=11,该溶液中离子浓度按由大到小的顺序为________.
(3)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,若稀释后两溶液的PH仍相等,则m________n(填“大于、等于、小于”).
(4)25℃时,在20 mL0.1 mol/L醋酸溶液加入VmL0.1 mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是________.

A.pH=3的醋酸溶液和pH=11的醋酸钠溶液中,水的电离程度相同
B.①点时pH=6,此时溶液中,c(CH3COO-)-c(Na+)=9.9×10-7 mol/L
C.②点时,溶液中的c(CH3COO-)=c(Na+)
D.③点时V=20 mL,此时溶液中c(CH3COO-)>c(Na+)
易拉罐主要成分探究:一般的易拉罐主要为铝合金,其中以铝铁合金和铝镁合金最为常见.本次实验选取可口可乐公司生产的雪碧汽水易拉罐作为探究的对象提出假设:易拉罐的主要成分是铝和铁.
探究过程及现象:
1.配制20%(密度为1.2 g/mL)的氢氧化钠溶液和6 mol/L的盐酸.
2.将易拉罐剪开,用砂纸打磨使表面油漆和氧化膜去掉,再剪取一小块进行实验.
实验一:用胶头滴管向装有铝合金的大试管中加入足量的氢氧化钠溶液,可以看到有气泡生成,反应一段时间后,溶液中还有不溶物.
实验二:用滴管继续向实验一的试管中逐滴加入6 mol/L的盐酸至足量,静置24小时.按实验顺序,该同学记录的现象如下:
①开始没有明显现象;
②有白色絮状沉淀生成;
③白色沉淀消失;
④原溶液中不溶物完全溶解,此时溶液呈浅绿色;
⑤静置24小时后,溶液呈棕黄色
实验三:再向该试管中加入一定量的氢氧化钠溶液,最终只得到红棕色沉淀
请回答下列问题:
(1)本实验所配制的c(NaOH)________c(HCl)(填“<”、“>”或“=”).
(2)写出“实验一”中发生反应的化学方程式________.
(3)实验二所得溶液为什么静置24小时后由浅绿色变为棕黄色?
________.
(4)写出“实验二”中产生①、②、③现象的反应离子方程式:________、________、________.
(6)由此可知该假设________(填“成立”、“不成立”或“无法确定”).
| 物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
①在30mL的大试管A中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合溶液.
②按如图1所示连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10分钟
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置,等待分层.
④分离出乙酸乙酯层并洗涤、干燥.
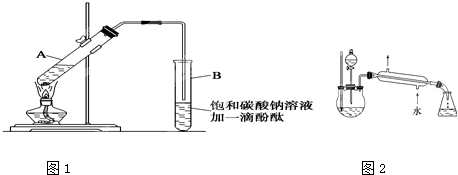
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为:
 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O(2)上述实验中饱和碳酸钠溶液的作用是:
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于其分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要理由是:
(4)指出步骤③所观察到的现象:
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
(5)某化学课外小组设计了如图2所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),试分析与上图的装置相比,此装置的主要优点.
(1)某溶液含两种相同物质的量的溶质,且其中只存在OH一、H+、
 、Cl一四种离子,且c(
、Cl一四种离子,且c( )>c(Cl-)>c(OH-)>c(H+),则这两种溶质是 .
)>c(Cl-)>c(OH-)>c(H+),则这两种溶质是 .(2)0.1mol?L-1的氨水与0.05mol?L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性: .
(3)已知:Ksp(RX)=1.8×10-10,Ksp(RY)=1.5×10-16,Ksp(R2Z)=2.0×10-12,则难溶盐RX、RY和R2Z的饱和溶液中,R+浓度由大到小的顺序是 .
(4)以石墨电极电解100mL 0.1mol?L-1CuSO4溶液.若阳极上产生气体的物质的量为0.01mol,则阴极上析出Cu的质量为 g.
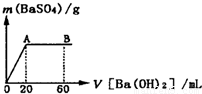
(5)向20mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如图所示,B点溶液的pH=7(假设体积可以直接相加),则c(HCl)= mol?L-1.
(6)在温度、容积相同的3个密闭容器中,按下表投入反应物,发生反应(H2(g)+
I2(g)?2HI(g)△H=-14.9kJ?mol-1),在恒温、恒容条件下,测得反应达
到平衡时的数据如下表:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol H2、1mol I2 | 2 mol HI | 4 mol HI |
| HI的浓度 | C1 | C2 | C3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 反应物转化率 | a1 | a2 | a3 |
A.α1+α2=1 B.2α2=α3 C.a+b=14.9 D.c1=c2=c3.
 查看习题详情和答案>>
查看习题详情和答案>>
请回答下列问题:
(1)A、C两元素形成的原子个数比为1:1且呈电中性的微粒的电子式为


(2)A、C、D可形成化合物W,其含有的化学键有
(3)A2和B2在工业上可合成一种重要的原料BA3.
①下列的措施有利于提高B2的转化率的是
A.采用20?50MPa的大气压
B.选用400?500℃的高温
C.使用催化剂
D.及时将BA3液化
②现有甲、乙两个固定体积的容器,在相同的体积和温度下,甲中充入2molBA3,反应达到平衡时,吸收Q1kJ的能量;乙中充入
1mol B2和3mol A2,反应达到平衡时,放出Q2kJ的能量;则合成BA3的热化学方程式为
| 高温高压 |
| 催化剂 |
| 高温高压 |
| 催化剂 |
③现有甲、乙两个体积和温度相同的容器,甲容器维持温度和体积不变,乙容器维持温度和压强不变,甲中充入2mol BA3,乙中充入1mol B2和3mol A2,当反应都达到平衡时,BA3的体积分数甲
(4)化合物甲、乙都由A、B、C三种元素组成,甲为弱碱,乙为强酸;常温下,若两溶液中水的电离程度相同.
①若乙溶液的pH=a,则甲溶液中水电离产生的C(H+)=
(5)用D2C2在酸性条件下处理含CN-的工业废水,将得到一种能够参与大气生态环境循环的气体以及C02等物质,请写出该反应的离子方程式