网址:http://m.1010jiajiao.com/timu3_id_434935[举报]

(1)气体a的化学式为
(2)溶液B加入硫酸酸化后再加入适宜氧化剂X得到溶液C,写出该反应的离子方程式
(3)制备硫酸铜溶液.常温下,O2、铜粉和稀硫酸三者在一起,几乎不反应,当加入溶液D后,随即生成硫酸铜.经理阅资料发现FeSO4对铜的氧化起催化作用.
A.第一步反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,则第二步反应的郭子方程式为
B.⑦操作中,配制Fe2(SO4)3溶液时应注意
(4)操作⑧的目的是得到较纯的硫酸铜溶液.加入适宜试剂Y调节pH至铁元素全部沉淀(离子浓度小于10-5mol.L-1),然后再过滤,浓缩、结晶等,则pH至少调节为
已知:Ksp[Cu(OH)2]≈1×1022,Ksp[Fe(OH)2]≈1×10-16,Ksp[Fe(OH)3]≈1×10-38
(5)科学家发现纳米级的Cu2O在太阳光照射下可以催化分解水.
A.一定温度下,在2L密闭容器中加入纳米级Cu2O,通入2mol水蒸气,发生如下反应:2H2O(g)═2H2(g)+O2(g)△H=+484kJ?mol-1
20min末测得n(O2)=0.16mol,则这段时间的反应速率v(H2)=
| [O2][H2]2 |
| [H2O]2 |
| [O2][H2]2 |
| [H2O]2 |
B.已知:2Cu2O(s)+O2(g)═4Cu2O(s)△H=-292kJ?mol-1 2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1
请写出炭粉还原CuO(s)制备Cu2O(s)的热化学方程式
2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
 H2(g)+
H2(g)+  F2(g)
= HF(g) △H = -269kJ·mol-1
F2(g)
= HF(g) △H = -269kJ·mol-1
H2(g)+  O2(g)
= H2O(g) △H = -242kJ·mol-1
O2(g)
= H2O(g) △H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g) 2NO2(g)
ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g)
ΔH 的体系中,n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.200 |
0.100 |
0.080 |
0.050 |
0.050 |
0.050 |
|
n(O2)(mol) |
0.100 |
0.050 |
0.040 |
0.025 |
0.025 |
0.025 |
(1) 已知:K800℃>K1000℃,则该反应的ΔH ______0(填“大于”或“小于”),用O2表示从0~2 s内该反应的平均速率为__________。
(2)能说明该反应已达到平衡状态的是________。
a.容器内颜色保持不变 b. 2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。
查看习题详情和答案>>
(14分)2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:①N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
②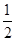 H2(g)+
H2(g)+ 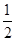 F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1
③H2(g)+ 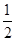 O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g) 2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
| n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(2)能说明该反应已达到平衡状态的是________。
A.容器内颜色保持不变 B. 2v逆(NO)=v正(O2)
C.容器内压强保持不变 D.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。 查看习题详情和答案>>
2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1 H2(g)+
H2(g)+  F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1
H2(g)+  O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g) 2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
| n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1) 已知:K800℃>K1000℃,则该反应的ΔH ______0(填“大于”或“小于”),用O2表示从0~2 s内该反应的平均速率为__________。
(2)能说明该反应已达到平衡状态的是________。
a.容器内颜色保持不变 b. 2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。 查看习题详情和答案>>
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
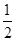 H2(g)+
H2(g)+ 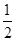 F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1H2(g)+
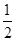 O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g)
 2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
| n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1) 已知:K800℃>K1000℃,则该反应的ΔH ______0(填“大于”或“小于”),用O2表示从0~2 s内该反应的平均速率为__________。
(2)能说明该反应已达到平衡状态的是________。
a.容器内颜色保持不变 b. 2v逆(NO)=v正(O2)
c.容器内压强保持不变 d.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。