摘要:23.下列哪个反应有最大的焓变? (A) (B) (C) (D)
网址:http://m.1010jiajiao.com/timu3_id_434931[举报]
(1)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1.某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如图1所示(实线).图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol.
①下列时间段平均反应速率最大的是
A.0~1min B.1~3min C.3~8min D.8~11min

②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验改变的条件是
(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图2所示.在0~30h内,CH4的平均生成速率v(Ⅰ)、v(Ⅱ)和v(Ⅲ)从大到小的顺序为
查看习题详情和答案>>
①下列时间段平均反应速率最大的是
A
A
,最小的是D
D
.A.0~1min B.1~3min C.3~8min D.8~11min

②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验改变的条件是
升高温度
升高温度
,曲线Ⅱ对应的实验改变的条件是增大压强或者是增大CO2浓度
增大压强或者是增大CO2浓度
.(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图2所示.在0~30h内,CH4的平均生成速率v(Ⅰ)、v(Ⅱ)和v(Ⅲ)从大到小的顺序为
v(Ⅲ)>v(Ⅱ)>v(Ⅰ)
v(Ⅲ)>v(Ⅱ)>v(Ⅰ)
.反应开始后的12小时内,在第Ⅱ
Ⅱ
种催化剂的作用下,收集的CH4最多.Ⅰ.指出下列变化能量是怎样转化的:
(1)学校燃烧煤煮饭
(3)用蓄电池点亮灯泡
Ⅱ.已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
(1)①反应速率最大的(即0~1、l~2、2~3、3~4、4~5min)时间段为
②反应速率最小的时间段为
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入下列物质以减慢反应速率
A.蒸馏水 B.少量CuCl2晶体 C.NaCl溶液
你认为他的做法可行的是加入
查看习题详情和答案>>
(1)学校燃烧煤煮饭
化学能变热能
化学能变热能
,(2)给手机的电池充电电能变化学能
电能变化学能
,(3)用蓄电池点亮灯泡
化学能变电能
化学能变电能
,(4)电解水得到O2和H2电能变化学能
电能变化学能
.Ⅱ.已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
2~3min
2~3min
.原因是由于反应放热,溶液温度升高,反应速率加快
由于反应放热,溶液温度升高,反应速率加快
②反应速率最小的时间段为
4~5min
4~5min
,原因是硫酸浓度降低,导致反应速率减慢
硫酸浓度降低,导致反应速率减慢
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入下列物质以减慢反应速率
A.蒸馏水 B.少量CuCl2晶体 C.NaCl溶液
你认为他的做法可行的是加入
AC
AC
(填相应字母);其中他的做法中也有不可行的,其不可行的理由是Zn与CuCl2反应,析出的铜覆在Zn的表面形成原电池,加快了化学反应
Zn与CuCl2反应,析出的铜覆在Zn的表面形成原电池,加快了化学反应
.(1)如图1,横坐标为溶液的pH,纵标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol?L-1时,可认为沉淀完全).试回答下列问题:

①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol?L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为
②从图1中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=
(2)25℃时,测得浓度为0.1mol?L-1的HA溶液的pH=3,则HA的电离常数Ka=
(3)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如2图所示(实线).图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6mol.
①下列时间段平均反应速率最大的是 ,最小的是 .
A.0-1min B.1-3min C.3-8min D.8-11min
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图2中虚线所示,曲线Ⅰ对应的实验改变的条件是 ,曲线Ⅱ对应的实验改变的条件是 .
③根据该反应特点,此反应自发进行的条件是 (填“高温”、“低温”或“任何温度”).
(4)铁是一种廉价的金属,除了做为重要的结构材料外,现又有了新的用途,磷酸聚合物铁锂电池以其廉价、高容量和安全性逐渐占据市场.高铁电池的研究也在进行中.下图是高铁电池的实验装置:
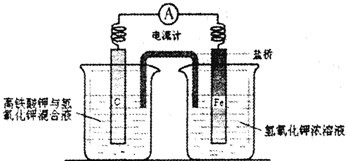
已知放电后,两极反应均生成Fe的+3价的化合物.
①该电池放电时正极发生的电极反应是 .
②若该电池属于二次电池,则充电时阴极反应的电极反应式为 .
查看习题详情和答案>>

①腐蚀铜板后的溶液中,若Cu2+、Fe3+和Fe2+浓度均为0.1mol?L-1,今向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为
②从图1中数据计算可得Fe(OH)2的溶度积Ksp[Fe(OH)2]=
(2)25℃时,测得浓度为0.1mol?L-1的HA溶液的pH=3,则HA的电离常数Ka=
(3)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如2图所示(实线).图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6mol.
①下列时间段平均反应速率最大的是
A.0-1min B.1-3min C.3-8min D.8-11min
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图2中虚线所示,曲线Ⅰ对应的实验改变的条件是
③根据该反应特点,此反应自发进行的条件是
(4)铁是一种廉价的金属,除了做为重要的结构材料外,现又有了新的用途,磷酸聚合物铁锂电池以其廉价、高容量和安全性逐渐占据市场.高铁电池的研究也在进行中.下图是高铁电池的实验装置:

已知放电后,两极反应均生成Fe的+3价的化合物.
①该电池放电时正极发生的电极反应是
②若该电池属于二次电池,则充电时阴极反应的电极反应式为