网址:http://m.1010jiajiao.com/timu3_id_434834[举报]
(原创)(10分) 置换反应的通式可表示为:
单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,则该反应的化学方程式为 。
(2)若乙是一种红色金属单质,化合物B的溶液呈浅绿色,则该反应的离子方程式为 。
(3)若化合物A是红棕色粉末状固体,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则该反应的化学方程式为 。
(4)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式
。
(5)若单质乙是黑色非金属固体单质,化合物B是一种金属氧化物,常常用作耐高温材料,则该反应的化学方程式为 。
(原创)(10分) 置换反应的通式可表示为:

单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,则该反应的化学方程式为 。
(2)若乙是一种红色金属单质,化合物B的溶液呈浅绿色,则该反应的离子方程式为 。
(3)若化合物A是红棕色粉末状固体,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则该反应的化学方程式为 。
(4)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式
。
(5)若单质乙是黑色非金属固体单质,化合物B是一种金属氧化物,常常用作耐高温材料,则该反应的化学方程式为 。
查看习题详情和答案>>
置换反应的通式可表示为:

单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若化合物A常温下呈液态,化合物B的焰色反应呈黄色,则该反应的化学方程式为 。
(2)若乙是一种红色金属单质,化合物B的溶液呈浅绿色,则该反应的离子方程式为 。
(3)若化合物A是红棕色粉末状固体,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则该反应的化学方程式为 。
(4)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式
。
(5)若单质乙是黑色非金属固体单质,化合物B是一种金属氧化物,常常用作耐高温材料,则该反应的化学方程式为 。
S8与NH3在无水条件下反应,得到一种二元化合物A,元素分析可知,A中含S元素69.60%。
A进行如下反应:

A、B、C、D的分子量范围在150~190之间,各元素含量都是质量分数。试回答下列各问题:
⑴写出A、B、C、D的化学式。
⑵写出生成A的化学方程式。
⑶写出A→B的化学方程式。
⑷只以A的骨架来
⑸D与一种无色液体(该液体是由常见的红棕色气体在加压下形成的)为等电子体,但D与无色液体的几何构型完全不同,试画出D的最稳定的Lewis结构式。并说明它是最稳定Lewis结构式的理由。
⑹在D的最稳定的Lewis结构式中,S原子的电子构型分别是多少?从电子构型看,D属于哪一类化合物?
查看习题详情和答案>>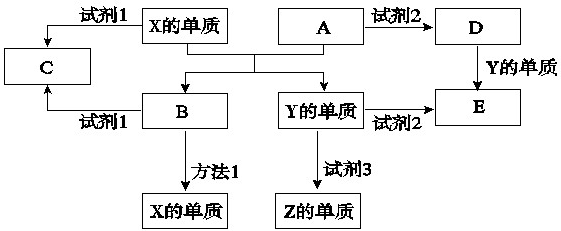
(1)工业上得到单质X的冶炼方法1是
(2)单质X与试剂1、单质Y与试剂2都能产生Z单质,试剂3是生活中常见的液体,请写出Y与试剂3反应的化学方程式是
| ||
| ||
(3)若试剂1是NaOH溶液,单质X与试剂1反应的离子方程式
(4)若试剂2是盐酸.
①如何检验D物质中的金属阳离子
②将D的饱和溶液滴加到沸水中得到有丁达尔效应的分散系,用离子方程式和平衡移动理论说明产生这种分散系的原因