摘要:3.检查水中HCN的方法是:往被怀疑有HCN的溶液中加适量KOH.FeSO4及FeCl3.写出反应式及实验现象.
网址:http://m.1010jiajiao.com/timu3_id_434669[举报]
制备氮化镁的装置示意图如图所示:

回答下列问题:
(1)检查装置气密性的方法是
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式
(3)C的作用是
(4)写出E中发生反应的化学方程式
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象
查看习题详情和答案>>

回答下列问题:
(1)检查装置气密性的方法是
微热b,这时G中有气泡冒出,停止加热冷却后,G中插在溶液里的玻璃管形成一段水柱,则气密性良好
微热b,这时G中有气泡冒出,停止加热冷却后,G中插在溶液里的玻璃管形成一段水柱,则气密性良好
,a的名称是分液漏斗
分液漏斗
,b的名称是圆底烧瓶
圆底烧瓶
;(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式
2NaNO2+(NH4)2SO4
2N2↑+Na2SO4+4H2O
| ||
2NaNO2+(NH4)2SO4
2N2↑+Na2SO4+4H2O
;
| ||
(3)C的作用是
除去氧气(及氮氧化物)
除去氧气(及氮氧化物)
,D的作用是除去水蒸气
除去水蒸气
,是否可以把C和D的位置对调并说明理由不能,对调后无法除去水蒸气
不能,对调后无法除去水蒸气
;(4)写出E中发生反应的化学方程式
N2+3Mg
Mg3N2
| ||
N2+3Mg
Mg3N2
;
| ||
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象
取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;
弃去上清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁.
弃去上清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁.
取少量产物于试管中,加入少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;
弃去上清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁.
.弃去上清液,加入盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁.
氮化铝(AlN)是一种新型无机材料,广泛应用与集成电路生产领域.某氮化铝中含有碳或氧化铝杂质,现用图Ⅰ中的一些装置来进行检验,使氮化铝样品和NaOH溶液反应AlN+NaOH+H2O=NaAlO2+NH3↑,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计).
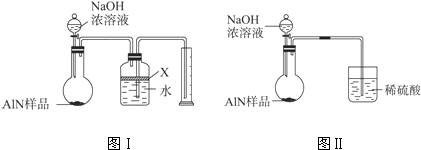
(1)实验有关操作为:a、往烧瓶中放入适量的AlN样品;b、从分液漏斗往烧瓶中加入过量的浓NaOH;c、检验装置的气密性;d、测定收集到水的体积.正确的操作顺序为 .
(2)本试验中检查装置气密性的方法是 .
(3)广口瓶中的试剂X可选用 (填选项的标号).
A.浓氢氧化钠溶液 B.酒精 C.植物油 D.CCl4
(4)广口瓶中液体未装满,测得NH3的体积将 (填“偏大”、“偏小”或“无影响”).
(5)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是 .
(6)若样品的质量为w g,氨气的体积为a L(标准状况),AlN的质量分数为 .
查看习题详情和答案>>

(1)实验有关操作为:a、往烧瓶中放入适量的AlN样品;b、从分液漏斗往烧瓶中加入过量的浓NaOH;c、检验装置的气密性;d、测定收集到水的体积.正确的操作顺序为
(2)本试验中检查装置气密性的方法是
(3)广口瓶中的试剂X可选用
A.浓氢氧化钠溶液 B.酒精 C.植物油 D.CCl4
(4)广口瓶中液体未装满,测得NH3的体积将
(5)实验结束后,若观察到锥形瓶中还有固体,则样品中含有的杂质是
(6)若样品的质量为w g,氨气的体积为a L(标准状况),AlN的质量分数为
某实验兴趣小组通过如下的实验装置制取乙炔,并进行一系列有关乙炔的性质实验,根据所学知识回答以下问题:

(1)写出实验室制乙炔的化学方程式 ;
检查装置气密性的方法是: .
(2)制得的乙炔通入KMnO4酸性溶液,观察到的现象是 ,乙炔发生了 反应;
(3)使用NaOH稀溶液代替水或饱和食盐水的原因是 .图中玻璃管的作用 .
查看习题详情和答案>>

(1)写出实验室制乙炔的化学方程式
检查装置气密性的方法是:
(2)制得的乙炔通入KMnO4酸性溶液,观察到的现象是
(3)使用NaOH稀溶液代替水或饱和食盐水的原因是
 某同学在气体体积测定仪中用镁和硫酸反应测定1mol氢气体积.完成下列填空:
某同学在气体体积测定仪中用镁和硫酸反应测定1mol氢气体积.完成下列填空:(1)A中发生反应的离子方程式为
(2)检查装置气密性的方法是塞上B瓶的玻璃塞,用橡皮塞塞紧A瓶加料口,当看到
(3)已知液体量瓶的刻度范围是110~130mL,实验时称取镁带的质量要控制在0.100~0.110g之间,目的是
(4)完成一次测定实验,需要2次用注射器抽气,其中需要记录的是第
(5)下列情况会导致实验结果偏高的是
a.镁表面的氧化膜没有除尽
b.储液瓶中的液体是水
c.未冷却到室温就读数
d.装置气密性不好. 查看习题详情和答案>>
 如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.
如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.( 1 )装置中有刻度的甲管可以用
碱式滴定管
碱式滴定管
代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是向乙中注入适量的水,使乙中液面高于甲中液面,静止观察,若液面差保持不变,则气密性良好
向乙中注入适量的水,使乙中液面高于甲中液面,静止观察,若液面差保持不变,则气密性良好
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同.装置如图所示,
有关实验数据记录于下表:
| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH0.1 mol/L40.00mL | HCl溶液 0.1 mol/L 40.00mL |
5 | t(a1)=155 s | t(b1)=7 s |
| 10 | t(a2)=310 s | t(b2)=16 s | ||
| 15 | t(a3)=465 s | t(b3)=30 s | ||
| 20 | t(a4)=665 s | t(b4)=54 s | ||
| … | … | … | ||
①每次实验至少需要用电子天平(能称准1mg) 称取镁粉
0.048
0.048
g;②冷却到25℃后,在读取气体体积时,首先应如何操作:
上下移动乙管,使甲管中液面和乙管中液面相平,再读数
上下移动乙管,使甲管中液面和乙管中液面相平,再读数
;③分析实验数据,t(a1)远远大于t(b1)的原因是
开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+)
开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+)
.(3)用图示装置,某同学设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为mg的镀锌铁皮与6mol?L-1 NaOH溶液反应.回答下列问题:(已知锌的密度为 ρ g/cm3)
①写出Zn镀层与NaOH溶液反应的离子方程式
Zn+2OH-+2H2O=Zn(OH)42-+H2↑
Zn+2OH-+2H2O=Zn(OH)42-+H2↑
②为提高测定的准确性,需将锥形瓶上的单孔橡胶塞换为双孔橡胶塞,另一孔插入
分液漏斗
分液漏斗
(填仪器名称)实验时先向锥形瓶中加入镀锌铁皮样品,塞上双孔塞,再加入NaOH溶液;
③已知实验前后甲管中液面读数差为V mL(实验条件的气体摩尔体积为Vm mol?L-1).则镀锌铁皮的锌镀层厚度为
| 65V×10-3 |
| 2ρSVm |
| 65V×10-3 |
| 2ρSVm |