摘要:2.在工业上也用水杨酸和甲醇.浓H2SO4按体积比2:5:1混合共热.以制取冬青油--扭伤时的外擦药,配制肥皂.牙膏.糖果的香精--水杨酸甲酯.写出合成反应的化学方程式,
网址:http://m.1010jiajiao.com/timu3_id_434572[举报]
已知:A是一种无色黏稠液体,它的水溶液可作消毒杀菌剂,B是一种过渡金属,C、D为同主族元素的单质,E、I在常温常压下为气态化合物.它们有如下转化关系(某些反应条件及生成物已略去).
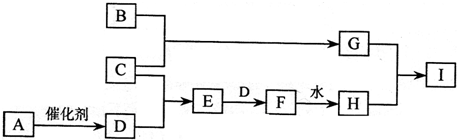
(1)在工业上可以用B所制容器贮存H的浓溶液,由此表现了H的
(2)写出用G与H的稀溶液制取I的离子方程式:
(3)若将E和I同时通入一集气瓶中,过一段时间可观察到的现象是
(4)A与E也可发生反应,写出其化学反应方程式
(5)在A→D的反应中,若生成了24g D,则转移的电子数是
查看习题详情和答案>>

(1)在工业上可以用B所制容器贮存H的浓溶液,由此表现了H的
强氧化
强氧化
性.(2)写出用G与H的稀溶液制取I的离子方程式:
FeS+2H+═Fe2++H2S↑
FeS+2H+═Fe2++H2S↑
(3)若将E和I同时通入一集气瓶中,过一段时间可观察到的现象是
瓶壁出现黄色固体和小液滴
瓶壁出现黄色固体和小液滴
,发生反应的化学方程式为2H2S+SO2═3S+2H2O
2H2S+SO2═3S+2H2O
,其中氧化产物与还原产物的质量比为2:1
2:1
.(4)A与E也可发生反应,写出其化学反应方程式
H2O2+SO2═H2SO4
H2O2+SO2═H2SO4
(5)在A→D的反应中,若生成了24g D,则转移的电子数是
9.03x1023
9.03x1023
个.甲醇是一种常用的燃料,工业上可以用CO和H2在一定条件下合成甲醇。
(1)已知CO(g)、H2(g)、CH3OH(1)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-726.5kJ/mol,则CO合成甲醇的热化学方程式为: 。
(2)在恒容密闭容器中CO与H2发生反应生成甲醇,各物质浓度在不同条件下的变化状况如图所示(开始时氢气的浓度曲线和8分钟后甲醇的浓度曲线未画出。4分钟和8分钟改变的条件不同):

①下列说法正确的是
A.起始时n(H2)为1.7mol
B.当容器内压强恒定时,说明反应达到平衡状态
C.4分钟时,改变的条件是升高温度
D.7分钟时,v(CO)=v(CH3OH)
②计算0~2min内平均反应速率v(H2)=
③在3min时该反应的平衡常数K= (计算结果)
④在图中画出8~12min之间c(CH3OH)曲线
(2)2009年,中国在甲醇燃料电池技术上获得突破,组装了自呼吸电池及主动式电堆,其装置原理如图甲。

①该电池的负极反应式为: 。
②乙池是一铝制品表面“钝化”装置,两极分别为铝制品和石墨。
M电极的材料是 ,该铝制品表面“钝化”时的反应式为: 。
查看习题详情和答案>>
已知:A是一种无色黏稠液体,它的水溶液可作消毒杀菌剂,B是一种过渡金属,C、D为同主族元素的单质,E、I在常温常压下为气态化合物.它们有如下转化关系(某些反应条件及生成物已略去).

(1)在工业上可以用B所制容器贮存H的浓溶液,由此表现了H的______性.
(2)写出用G与H的稀溶液制取I的离子方程式:______
(3)若将E和I同时通入一集气瓶中,过一段时间可观察到的现象是______,发生反应的化学方程式为______,其中氧化产物与还原产物的质量比为______.
(4)A与E也可发生反应,写出其化学反应方程式______
(5)在A→D的反应中,若生成了24g D,则转移的电子数是______个.
查看习题详情和答案>>

(1)在工业上可以用B所制容器贮存H的浓溶液,由此表现了H的______性.
(2)写出用G与H的稀溶液制取I的离子方程式:______
(3)若将E和I同时通入一集气瓶中,过一段时间可观察到的现象是______,发生反应的化学方程式为______,其中氧化产物与还原产物的质量比为______.
(4)A与E也可发生反应,写出其化学反应方程式______
(5)在A→D的反应中,若生成了24g D,则转移的电子数是______个.
查看习题详情和答案>>
下已知A~K均为中学化学中的常见物质,它们之间的转化关系如图所示,其中A、D为金属单质,反应过程中生成的水及其他部分产物已略去.

请回答以下问题:
(1)A和B的反应在工业上也叫做
(2)F和K的化学式分别为
(3)写出H在空气中生成I的化学方程式
(4)J中的阳离子应该如何检验?
查看习题详情和答案>>

请回答以下问题:
(1)A和B的反应在工业上也叫做
铝热
铝热
反应,B物质为红棕色
红棕色
颜色的固体.(2)F和K的化学式分别为
NaAlO2
NaAlO2
、Al(OH)3
Al(OH)3
.(3)写出H在空气中生成I的化学方程式
4Fe(OH)2+O2+2H2O═4Fe(OH)3
4Fe(OH)2+O2+2H2O═4Fe(OH)3
.(4)J中的阳离子应该如何检验?
取少量溶液于小试管中,滴加几滴KSCN溶液,若溶液出现红色,说明含有Fe3+
取少量溶液于小试管中,滴加几滴KSCN溶液,若溶液出现红色,说明含有Fe3+
.某一反应体系中,有反应物和生成物共五种物质,这五种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中Cl2、H2O均为生成物.
(1)该反应中的氧化剂是
(2)该反应中,氧化产物与还原产物的物质的量之比为
(3)若产生的气体在标准状况下体积为2.24L,则反应过程中转移电子的数目为
(NA表示阿伏伽德罗常数的值),发生反应的KMnO4的质量为
(4)购买的浓盐酸(密度为1.19g/cm3)在工业上是用HCl气体(标准状况)与H2O按体积比500:1配制成的,则该盐酸的物质的量浓度是
查看习题详情和答案>>
(1)该反应中的氧化剂是
KMnO4
KMnO4
,氧化产物为Cl2
Cl2
.(2)该反应中,氧化产物与还原产物的物质的量之比为
5:2
5:2
.(3)若产生的气体在标准状况下体积为2.24L,则反应过程中转移电子的数目为
0.2
0.2
NA(NA表示阿伏伽德罗常数的值),发生反应的KMnO4的质量为
6.32
6.32
g.(4)购买的浓盐酸(密度为1.19g/cm3)在工业上是用HCl气体(标准状况)与H2O按体积比500:1配制成的,则该盐酸的物质的量浓度是
14.6
14.6
mol/L(结果保留一位小数).