摘要:某元素Bi在自然界储量较低.其存在形式有元素态和化合态(主要为Bi2O3和Bi2S3).Bi是较弱的导体.其电导随温度的升高而降低.但熔触后迅速增加.Bi的熔点是545K.熔融后体积缩小.Bi的沸点为1883K(p=1.014×105Pa).该温度下的蒸气密度为3.011g/L.而在2280K和2770K时蒸气密度则分别是1.122g/L和0.919g/L. Bi不与无氧化性的稀酸反应.但可被浓H2SO4或王水氧化为硫酸盐或氯化物.Bi (Ⅲ)的盐可与碱金属卤化物或硫酸盐作用形成络合物(如BiCl4-.BiCl52-.BiCl63-和Bi (SO4)2-等).Bi也形成BiN和BiH3等化合物.在这些化合物中.Bi的氧化态为-Ⅲ.Bi还可生成Bi2O4.其中Bi的氧化态为Ⅳ.Bi(Ⅲ)的卤化物也可由Bi和卤素直接反应生成.Bi(Ⅲ)的许多盐可溶解在乙醇和丙酮中.这些盐在强酸性介质中是稳定的.在中性介质中则生成含氧酸盐沉淀.并渐渐转化成如XONO3的型体.Bi(Ⅲ)的盐在碱性溶液中可被强氧化剂氧化成Bi(V)的化合物.在酸性介质中Bi(Ⅴ)的化合物能将Mn2+氧化为MnO4-. Bi的化合物有毒.在治消化道溃疡药及杀菌药中含少量Bi的化合物.在碱性介质中.用亚锡酸盐可将Bi的化合物还原为游离态的Bi.这可用于Bi的定性分析. 请回答下列问题:1.写出Bi原子的电子构型和在门捷列夫元素周期表中的位置,
网址:http://m.1010jiajiao.com/timu3_id_434560[举报]
碳元素的化合物如甲烷、碳酸钙在自然界储量丰富,分布广泛,有非常重要的用途.
工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷平衡含量的影响如下图:
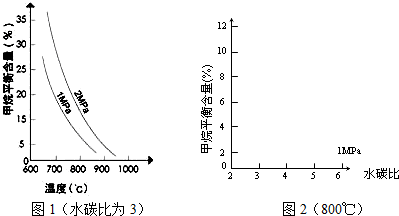
(1)温度对该反应的反应速率和平衡移动的影响是
(2)其他条件不变,请在图2中画出压强为2MPa时,CH4平衡含量与水碳比之间关系曲线.
(3)已知:在700℃,1MPa时,1mol CH4与一定量H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,对应的热量变化为aKJ,则这6分钟的平均反应速率v(H2)为
(4)CaCO3是一种难溶物,其Ksp=2.8×10-9.现将 amol/L的CaCl2溶液与2.0×10-4mol/L Na2CO3溶液等体积混合(假设溶液体积可直接相加),若要生成CaCO3沉淀,则a的最小值为
查看习题详情和答案>>
工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
已知温度、压强和水碳比[n(H2O)/n(CH4)]对甲烷平衡含量的影响如下图:

(1)温度对该反应的反应速率和平衡移动的影响是
其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动
其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动
.(2)其他条件不变,请在图2中画出压强为2MPa时,CH4平衡含量与水碳比之间关系曲线.
(3)已知:在700℃,1MPa时,1mol CH4与一定量H2O在1L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,对应的热量变化为aKJ,则这6分钟的平均反应速率v(H2)为
0.4 mol/(L?min)
0.4 mol/(L?min)
;此条件下该反应的热化学方程式为CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+1.25a KJ/mol
CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+1.25a KJ/mol
.(4)CaCO3是一种难溶物,其Ksp=2.8×10-9.现将 amol/L的CaCl2溶液与2.0×10-4mol/L Na2CO3溶液等体积混合(假设溶液体积可直接相加),若要生成CaCO3沉淀,则a的最小值为
5.6×10-5
5.6×10-5
mol/L.某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
A.在自然界中只以化合态的形式存在 B.单质常用作半导体材料和光导纤维
C.最高价氧化物不与酸反应 D.气态氢化物比甲烷稳定
查看习题详情和答案>>
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素
A.在自然界中能以游离态的形式存在
B.单质常用作半导体材料和光导纤维
C.最高价氧化物性质非常稳定,但在一定条件下可以显氧化性
D.气态氢化物比甲烷稳定
查看习题详情和答案>>