摘要:5.氮气的大规模制备是通过分馏液态空气来实现.随着氮气的大量使用.仍然促使人们建立某种比空气液化和分馏法成本更低的制备工艺.请你设想在室温下由空气分离氮气和氧气的方法.
网址:http://m.1010jiajiao.com/timu3_id_434504[举报]
(2013?烟台一模)某化学小组采用下图装置模拟电解饱和食盐水制备氢气,通过氢气还原氧化铜测定Cu的相对原子质量,同时检验氯气的氧化性(图中夹持和加热仪器已经略去).

(1)写出装置甲中反应的离子方程式
(2)①装置乙烧杯中液体的作用是
a.I2-淀粉溶液 b.NaOH溶液 c. FeCl2与KSCN混合溶液 d.Na2SO3溶液
②加热装置丙中的氧化铜粉末之前,除了要检查该装置的气密性还需进行的必要操作是
(3)利用装置丙测定Cu的相对原子质量,现有两种方案:①测得反应前后洗气瓶B及其中液体质量差m1,②测得反应前后U形管及其中固体质量差m2.你认为合理的方案为
,该方案在反应后硬质玻璃管冷却过程中没有一直通氢气,会导致测定Cu韵相对原子质量
查看习题详情和答案>>

(1)写出装置甲中反应的离子方程式
2Cl-+2H2O
H2↑+Cl2↑+2OH-
| ||
2Cl-+2H2O
H2↑+Cl2↑+2OH-
.为完成上述实验,正确的连按方式为a连接
| ||
e
e
,b连接c
c
(填字母).(2)①装置乙烧杯中液体的作用是
吸收多余的氯气,防止环境污染
吸收多余的氯气,防止环境污染
.A瓶内盛装的溶液最好是c
c
(填字母).a.I2-淀粉溶液 b.NaOH溶液 c. FeCl2与KSCN混合溶液 d.Na2SO3溶液
②加热装置丙中的氧化铜粉末之前,除了要检查该装置的气密性还需进行的必要操作是
通入氢气排尽装置内空气
通入氢气排尽装置内空气
.(3)利用装置丙测定Cu的相对原子质量,现有两种方案:①测得反应前后洗气瓶B及其中液体质量差m1,②测得反应前后U形管及其中固体质量差m2.你认为合理的方案为
①
①
(填“①”或“②”).若采用测得反应后硬质玻璃管中剩余固体的质量m3的方案,已知O的相对原子质量为16,实验中氧化铜样品质量为m,则测定Cu的相对原子质量的表达式为| 16m3 |
| m-m3 |
| 16m3 |
| m-m3 |
偏大
偏大
(填“偏大”、“偏小”或“无影响”),理由是反应生成的铜被空气的氧气氧化使m3数据增大,导致测定结果偏大
反应生成的铜被空气的氧气氧化使m3数据增大,导致测定结果偏大
.
硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物.
(1)将SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀.溶液由棕黄色变为浅绿色用离子方程式表示为 ,后又由浅绿色变为棕黄色的离子方程式为 .
(2)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCI为原料可以合成有重要用途的硫化钙、硫酸钾、亚硫酸氢铵等物质.合成路线如图:
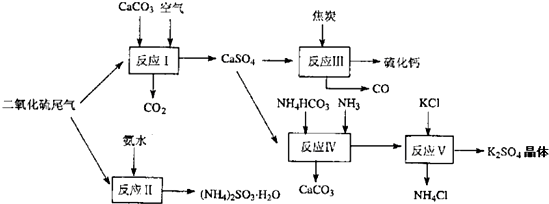
写出反应反应Ⅳ的化学方程式 ;
反应III中氧化剂与还原剂的物质的量之比为 ;
反应V在25'C、40%乙二醇溶液中进行,该复分解反应能顺利进行的原因是 .
(3)新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下能使SO2分解,减小工业废气对环境的影响,它由铁酸锌(ZnFe2O4)经高温还原制得,转化流程如图所示:
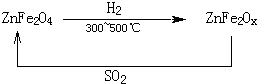
若2molZnFe2Ox与SO2反应可生成 0.75molS,x= ,写出铁酸锌高温下被还原生成氧缺位铁酸锌的化学方程式
(4)石灰石-石膏湿法烟气脱硫工艺技术的原理是烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4.2H2O),写出该反应的化学方程式 .某电厂用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则可生产石膏 t.
查看习题详情和答案>>
(1)将SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀.溶液由棕黄色变为浅绿色用离子方程式表示为
(2)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCI为原料可以合成有重要用途的硫化钙、硫酸钾、亚硫酸氢铵等物质.合成路线如图:

写出反应反应Ⅳ的化学方程式
反应III中氧化剂与还原剂的物质的量之比为
反应V在25'C、40%乙二醇溶液中进行,该复分解反应能顺利进行的原因是
(3)新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下能使SO2分解,减小工业废气对环境的影响,它由铁酸锌(ZnFe2O4)经高温还原制得,转化流程如图所示:

若2molZnFe2Ox与SO2反应可生成 0.75molS,x=
(4)石灰石-石膏湿法烟气脱硫工艺技术的原理是烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4.2H2O),写出该反应的化学方程式
(2012?昆明模拟)碳酸钙常用作牙膏的摩擦剂.某同学设计了一种制备碳酸钙的方案,其流程图如下.(所用石灰石含有杂质SiO2)

回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨.标准状况下生成二氧化碳的体积为
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶液性滤渣的成分为
(3)第③步反应一般不采用通入CO2的主要原因是
(4)CaCO3是一种难溶液物质,25℃时其KSP=2.8×10-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是
(5)某生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下

与前一方案相比较,该方案的优点是
查看习题详情和答案>>

回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨.标准状况下生成二氧化碳的体积为
2.24×107
2.24×107
L,石灰石中碳酸钙的质量分数为90.9
90.9
%.(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶液性滤渣的成分为
CaSiO3
CaSiO3
.(3)第③步反应一般不采用通入CO2的主要原因是
通入CO2的量不易控制,使生成的碳酸钙在CO2过量的条件下溶解.
通入CO2的量不易控制,使生成的碳酸钙在CO2过量的条件下溶解.
,相应的离子方程式为CaCO3+CO2+H2O═Ca2++2HCO3-
CaCO3+CO2+H2O═Ca2++2HCO3-
.(4)CaCO3是一种难溶液物质,25℃时其KSP=2.8×10-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是
5.6×10-5 mol?L-1
5.6×10-5 mol?L-1
.(5)某生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下

与前一方案相比较,该方案的优点是
不需要加热,操作简便,减少来自燃料的污染
不需要加热,操作简便,减少来自燃料的污染
.硫酸的工业制备是一个重要的化工生产过程,但同时在生产过程中会产生大量SO2等污染物。
(1)将SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀。溶液由棕黄色变为浅绿色用离子方程式表示为_____,后又由浅绿色变为棕黄色的离子方程式为_____。
(2)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCI为原料可以合成有重要用途的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
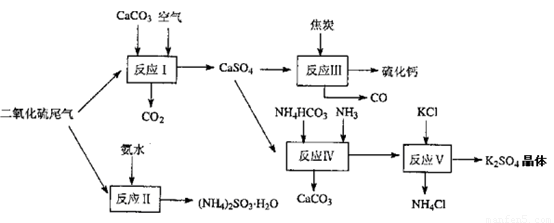
写出反应反应Ⅳ的化学方程式 ;
反应III中氧化剂与还原剂的物质的量之比为__ __;
反应V在25'C、40%乙二醇溶液中进行,该复分解反应能顺利进行的原因是 。
(3)新型纳米材料氧缺位铁酸锌(ZnFe2Ox),常温下能使SO2分解,减小工业废气对环境的影响,它由铁酸锌(ZnFe2O4)经高温还原制得,转化流程如下图所示:
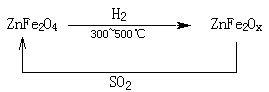
若2molZnFe2Ox与SO2反应可生成 0.75molS,x= ,写出铁酸锌高温下被还原生成氧缺位铁酸锌的化学方程式
(4)石灰石-石膏湿法烟气脱硫工艺技术的原理是烟气中的二氧化硫与浆液中的碳酸钙以及空气反应生成石膏(CaSO4.2H2O),写出该反应的化学方程式 。某电厂用煤300t(煤中含硫的质量分数为2.5%),若燃烧时煤中的硫全部转化为二氧化硫,用该方法脱硫时有96%的硫转化为石膏,则可生产石膏 t。
查看习题详情和答案>>
已知木炭在一定条件下与浓硝酸反应生成两种+4价的氧化物,为了探究一氧化氮(NO)能否与过氧化钠反应,以及反应后的产物中是否有亚硝酸钠(NaNO2),某小组同学设计了如图所示装置(夹持仪器和连接用的胶管已经省略)。
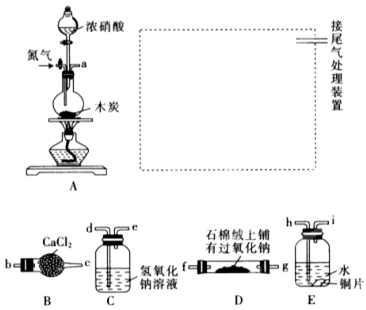
(1)①为了完成该实验,虚线框内还需要连接B~E四套装置,按气流方向连接的顺序为a →( )( )→ ( )( )→ ( ) ( )→ ( )( )(填仪器接口的字母编号)。
②连接好仪器,检查气密性,装入药品后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯,通入氮气的主要目的是________________________。
(2)装置E中观察到的主要实验现象有_______________。
(3)装置C的作用是__________________。
(4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮。装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成:_______________(写出检验步骤及现象)。
(5)亚硝酸钠在酸性条件下可将I-氧化为I2,该反应常用于亚硝酸钠含量的测定,请写出该反应的离子方程式:___________________。
查看习题详情和答案>>
②连接好仪器,检查气密性,装入药品后,要通入一段时间的氮气,再滴加浓硝酸,点燃酒精灯,通入氮气的主要目的是________________________。
(2)装置E中观察到的主要实验现象有_______________。
(3)装置C的作用是__________________。
(4)某同学经查阅资料后发现亚硝酸是弱酸,性质不稳定,室温下易分解成一氧化氮。装置D中充分反应后,设计实验证明D中是否有亚硝酸钠生成:_______________(写出检验步骤及现象)。
(5)亚硝酸钠在酸性条件下可将I-氧化为I2,该反应常用于亚硝酸钠含量的测定,请写出该反应的离子方程式:___________________。