摘要:2.写出最后一步配平的化学方程式,
网址:http://m.1010jiajiao.com/timu3_id_434497[举报]
Na2O2是一种强氧化剂,H2是常用的还原剂.我们设想Na2O2与H2也能发生化学反应.某化学小组探究Na2O2与H2的反应,首先对Na2O2与H2的反应进行预测(方程式均未配平):
①Na2O2+H2→NaOH②Na2O2+H2→Na+H2O
③Na2O2+H2→Na2O+H2O④Na2O2+H2→NaH+O2
⑤Na2O2+H2→NaOH+O2⑥Na2O2+H2→NaOH+H2O
(1)小组同学查阅相关资料,理论上说明Na2O2与H2在加热条件下能发生反应,从理论分析,上述①~⑥的预测中,合理的预测是 (填写序号).
(2)化学小组设计实验证明自己的预测,实验装置如下:
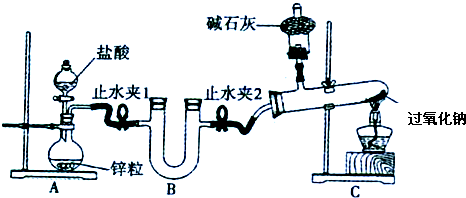
实验步骤(下列没有按操作顺序排列):a、在装置中装好相应的试剂;b、连接装置,检查装置的气密性;c、加热C装置中的过氧化钠;d、反应结束后,撤离酒精灯,等试管冷却后停止通氢气;e、打开止水夹,再打开A装置中的分液漏斗开关,通入氢气.
回答下列问题:
①实验步骤的正确操作顺序为 (填写字母).
②B装置内应放的试剂是 ,作用是 ;C装置中,干燥管中碱石灰的作用是 .
③装置C中,通氢气进入试管内的导管没有画出,请在装置图内画出.
④实验发现过氧化钠在加热条件下与氢气可以反应,观察到C装置试管中的实验现象为 .
⑤用最简单的方法证明装置C中过氧化钠完全反应: .
查看习题详情和答案>>
①Na2O2+H2→NaOH②Na2O2+H2→Na+H2O
③Na2O2+H2→Na2O+H2O④Na2O2+H2→NaH+O2
⑤Na2O2+H2→NaOH+O2⑥Na2O2+H2→NaOH+H2O
(1)小组同学查阅相关资料,理论上说明Na2O2与H2在加热条件下能发生反应,从理论分析,上述①~⑥的预测中,合理的预测是
(2)化学小组设计实验证明自己的预测,实验装置如下:

实验步骤(下列没有按操作顺序排列):a、在装置中装好相应的试剂;b、连接装置,检查装置的气密性;c、加热C装置中的过氧化钠;d、反应结束后,撤离酒精灯,等试管冷却后停止通氢气;e、打开止水夹,再打开A装置中的分液漏斗开关,通入氢气.
回答下列问题:
①实验步骤的正确操作顺序为
②B装置内应放的试剂是
③装置C中,通氢气进入试管内的导管没有画出,请在装置图内画出.
④实验发现过氧化钠在加热条件下与氢气可以反应,观察到C装置试管中的实验现象为
⑤用最简单的方法证明装置C中过氧化钠完全反应:
北京市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
写出Na2SO3稀溶液与I2反应的离子方程式是
(3)已知:I2+2S2O32-=2I-+S4O62-.
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L 的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全所依据的现象
②b中反应所产生的I2的物质的量是
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
查看习题详情和答案>>
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计算) | 20~50mg/kg |
| 分装日期 | \ |
| 分装企业 | \ |
1
1
KIO3+5
5
KI+5
5
H2SO4═3
3
K2SO4+3
3
I2+3
3
H2O(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
写出Na2SO3稀溶液与I2反应的离子方程式是
I2+SO32-+H2O=2I-+SO42-+2H+
I2+SO32-+H2O=2I-+SO42-+2H+
.(3)已知:I2+2S2O32-=2I-+S4O62-.
某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L 的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全所依据的现象
滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色
滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色
.②b中反应所产生的I2的物质的量是
1.0×10-5
1.0×10-5
mol.③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
423/w
423/w
mg/kg.(2011?绵阳模拟)市场销售的某种食用精制盐包装袋上有如下说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
(2)现有①淀粉溶液②淀粉KI试纸③水④食醋.要检验是否为加碘盐,最佳试剂编号为
(3)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中; b.加入适量Na2SO3稀溶液; c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是
(4)已知:I2+2S2O32-=2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;配成100mL
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,取25ml逐滴加入物质的量浓度为2.0×10-3mol?L-1的Na2S2O3溶液2.5mL,恰好反应完全.
①a歩中用到的定量玻璃仪器是
②判断c中反应恰好完全依据的现象是
③b中反应所产生的I2的物质的量是
④根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
mg/kg.
查看习题详情和答案>>
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
1
1
KIO3+5
5
KI+3
3
H2SO4=3
3
K2SO4+3
3
I2+3
3
H2O(2)现有①淀粉溶液②淀粉KI试纸③水④食醋.要检验是否为加碘盐,最佳试剂编号为
②④
②④
,写出离子方程式IO3-+5I-+6CH3COOH═3I2+3H2O+6CH3COO-
IO3-+5I-+6CH3COOH═3I2+3H2O+6CH3COO-
.(3)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是
I2+SO32-+H2O═2I-+SO42-+2H+
I2+SO32-+H2O═2I-+SO42-+2H+
;②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中; b.加入适量Na2SO3稀溶液; c.分离出下层液体.
以上设计中遗漏的操作及在上述步骤中的位置是
在步骤b后,增加操作:将分液漏斗充分振荡后静置
在步骤b后,增加操作:将分液漏斗充分振荡后静置
.(4)已知:I2+2S2O32-=2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;配成100mL
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,取25ml逐滴加入物质的量浓度为2.0×10-3mol?L-1的Na2S2O3溶液2.5mL,恰好反应完全.
①a歩中用到的定量玻璃仪器是
100mL的容量瓶
100mL的容量瓶
.②判断c中反应恰好完全依据的现象是
溶液由蓝色恰好变为无色
溶液由蓝色恰好变为无色
.③b中反应所产生的I2的物质的量是
1.0×10-5
1.0×10-5
mol.④根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
| 423 |
| w |
| 423 |
| w |
(2013?湛江二模)为了探究SO2与Na2O2的反应是否类似于CO2,甲同学设计了如图实验装置.回答下列问题:

(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃.甲同学因此认为SO2与Na2O2的反应不同于CO2.请按甲同学的观点写出反应的化学方程式
(2)乙同学认为无论反应原理如何,最终都有O2产生.乙同学的理由是
按照乙同学的观点,该装置需作的改进是:
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:
①Na2SO3; ②Na2SO4; ③Na2SO3和Na2SO4
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2mol?L-1 HCl,1mol?L-1HNO3,1mol?L-1 BaCl2,1mol?L-1 Ba(NO3)2,
(0.01mol?L-1KMnO4酸性溶液.)
(4)生成物中亚硫酸钠含量的测定:①取a克生成物配制成100ml溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.0100mol?L-1碘水进行滴定,滴定终点现象为
②计算:生成物中亚硫酸钠的质量分数为
查看习题详情和答案>>

(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃.甲同学因此认为SO2与Na2O2的反应不同于CO2.请按甲同学的观点写出反应的化学方程式
SO2+Na2O2=Na2SO4
SO2+Na2O2=Na2SO4
.(2)乙同学认为无论反应原理如何,最终都有O2产生.乙同学的理由是
A中生成的SO2气体中含有水蒸气
A中生成的SO2气体中含有水蒸气
.按照乙同学的观点,该装置需作的改进是:
在A和B之间连接一个装有浓硫酸的洗气瓶
在A和B之间连接一个装有浓硫酸的洗气瓶
.(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:
①Na2SO3; ②Na2SO4; ③Na2SO3和Na2SO4
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2mol?L-1 HCl,1mol?L-1HNO3,1mol?L-1 BaCl2,1mol?L-1 Ba(NO3)2,
(0.01mol?L-1KMnO4酸性溶液.)
| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中. | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入 足量的1 mol?L-1盐酸 足量的1 mol?L-1盐酸 ,再滴加1 mol?L-1 BaCl2溶液 1 mol?L-1 BaCl2溶液 . |
有白色沉淀生成 有白色沉淀生成 ,则证明生成物中含Na2SO4. |
| 步骤3:往Ⅱ试管中 2~3滴0.01mol?L-1KMnO4酸性溶液,振荡 2~3滴0.01mol?L-1KMnO4酸性溶液,振荡 删除此空 删除此空 . |
若 KMnO4溶液紫红色褪去 KMnO4溶液紫红色褪去 ,则说明生成物中有Na2SO3;若 KMnO4溶液紫红色不褪去 KMnO4溶液紫红色不褪去 删除此空 删除此空 ,则说明生成物中没有Na2SO3. |
溶液出现蓝色,且半分钟内不褪去
溶液出现蓝色,且半分钟内不褪去
,记录数据,重复滴定2次,平均消耗碘水20.00mL.②计算:生成物中亚硫酸钠的质量分数为
0.252/a
0.252/a
.(14分)为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
⑴工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式 。
⑵滤液中含钒的主要成分为 (写化学式)。
⑶该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式 ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为 、 。

⑷用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应的离子方程式为□VO2+ +□H2C2O4+□_____=□VO2++□CO2↑+□H2O,试将其配平。
⑸全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2+ +V2++2H+
 VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
查看习题详情和答案>>
VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
查看习题详情和答案>>