摘要:26. === (3) ZnSO4溶液或ZnC12溶液
网址:http://m.1010jiajiao.com/timu3_id_433985[举报]
铁及铁的化合物应用广泛,如FeCl3可用做催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图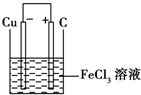
 (标出正、负极材料及电解质溶液),并写出电极反应式.正极反应
(标出正、负极材料及电解质溶液),并写出电极反应式.正极反应
(3)某科研人员发现劣质不锈钢在某些盐溶液中腐蚀现象明显.请从提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀.有关反应的化学方程式①
(4)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2.该电池正极发生的电极反应为
查看习题详情和答案>>
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是
2Fe3++Cu═2Fe2++Cu2+
2Fe3++Cu═2Fe2++Cu2+
.(2)若将(1)中的反应设计成原电池,请画出原电池的装置图


2Fe3++2e-═2Fe2+或Fe3++e-═2e2+
2Fe3++2e-═2Fe2+或Fe3++e-═2e2+
,负极反应Cu-2e-═Cu2+
Cu-2e-═Cu2+
.(3)某科研人员发现劣质不锈钢在某些盐溶液中腐蚀现象明显.请从提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀.有关反应的化学方程式①
CuO+H2SO4═CuSO4+H2O
CuO+H2SO4═CuSO4+H2O
②CuSO4+Fe═FeSO4+Cu
CuSO4+Fe═FeSO4+Cu
.劣质不锈钢腐蚀的实验现象不锈钢表面有红色物质生成,溶液颜色由蓝色变成浅绿色
不锈钢表面有红色物质生成,溶液颜色由蓝色变成浅绿色
.(4)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2.该电池正极发生的电极反应为
2SOCl2+4e-═4Cl-+S+SO2
2SOCl2+4e-═4Cl-+S+SO2
.(2012?凯里市模拟)对于处于平衡状态的反应:X(g)+3Y(s)?2Z(g),△H<0.为了使平衡向生成Z的方向移动,应选择的条件是( )
①高温 ②低温 ③高压 ④低压 ⑤加正催化剂 ⑥分离出Z.
①高温 ②低温 ③高压 ④低压 ⑤加正催化剂 ⑥分离出Z.
查看习题详情和答案>>
Ⅰ某温度下,密闭容器中充入1mol N2和3mol H2,使之反应合成NH3,平衡后,测得NH3的体积分数为w,如果温度不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为w,N2、H2、NH3的物质的量分别用x、y、z表示.
(1)恒温恒容条件下:若x=0.75mol,则y=
(2)恒温恒压条件下,x、y、z(均不小于0)满足的一般条件是
Ⅱ一定条件下,可逆反应X(g)+Y(g) 2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1mol/L; c (Z)=1.6mol/L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是
2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1mol/L; c (Z)=1.6mol/L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是
Ⅲ在10℃和4×105Pa的条件下,当反应aA(g) dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
(1)压强从4×105Pa增加到6×105Pa时,平衡向
(2)压强从10×105Pa增加到20×105Pa时,平衡向
查看习题详情和答案>>
(1)恒温恒容条件下:若x=0.75mol,则y=
2.25
2.25
,z=0.5
0.5
.(2)恒温恒压条件下,x、y、z(均不小于0)满足的一般条件是
x:y=1:3
x:y=1:3
.Ⅱ一定条件下,可逆反应X(g)+Y(g)
 2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1mol/L; c (Z)=1.6mol/L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是
2Z(g)达到平衡时,各物质的平衡浓度为c(X)=0.5mol/L;c(Y)=0.1mol/L; c (Z)=1.6mol/L若用a、b、c 分别表示X Y Z的初始浓度(mol/L)则a、b应满足的关系是a=b+0.4
a=b+0.4
,a的取值范围为0.4≤a≤1.3
0.4≤a≤1.3
Ⅲ在10℃和4×105Pa的条件下,当反应aA(g)
 dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:
dD(g)+eE(g),建立平衡后,维持温度不变而压强改变,测得D的浓度变化如下:| 压强(Pa) | 4×105 | 6×105 | 10×105 | 20×105 |
| D的浓度(mol/L) | 0.085 | 0.126 | 0.200 | 0.440 |
逆
逆
(填“正”或“逆”)方向移动,理由是压强从4×105Pa到6×105Pa时,增加为原来的1.5倍,而c(D)=6/4×0.085mol/L=0.128mol/L>0.126,所以实际平衡向逆反应方向移动
压强从4×105Pa到6×105Pa时,增加为原来的1.5倍,而c(D)=6/4×0.085mol/L=0.128mol/L>0.126,所以实际平衡向逆反应方向移动
(2)压强从10×105Pa增加到20×105Pa时,平衡向
正
正
(填“正”或“逆”)方向移动.某校综合实践小组用废铁屑制FeCl3,用作印刷电路铜板腐蚀剂,并回收铜.活动过程如下:

(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
装置图:
 ,正极反应
,正极反应
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol?L-1,请参照下表完成除去CuCl2溶液中Fe3+和Fe2+的实验步骤的相关问题:
①通入足量氯气,目的
②加入CuO调节溶液的PH至
③过滤除去
(4)学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
(5)电解过程中的阴极材料是
(6)采用排液法收集氯气,该液体是
查看习题详情和答案>>

(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式
2Fe3++Cu═2Fe2++Cu2+
2Fe3++Cu═2Fe2++Cu2+
.(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式.
装置图:


2Fe3++2e-═2Fe2+
2Fe3++2e-═2Fe2+
,负极反应Cu-2e-═Cu2+
Cu-2e-═Cu2+
.(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol?L-1,请参照下表完成除去CuCl2溶液中Fe3+和Fe2+的实验步骤的相关问题:
| 氢氧化物开始沉淀时的PH | 氢氧化物沉淀完全时的PH | |
| Fe3+ Fe2+ Cu2+ |
1.9 7.0 4.7 |
3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
将Fe2+氧化成Fe3+
将Fe2+氧化成Fe3+
;②加入CuO调节溶液的PH至
3.2-4.7
3.2-4.7
;③过滤除去
Fe(OH)3
Fe(OH)3
(填化学式)(4)学生甲对黄色溶液A和绿色溶液C进行定性实验,完成下表:
| 编号 | 实验内容 | 实验操作 | 预期现象和结论 |
| ① | 检验黄色溶液A中是否含有Fe2+ | 取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液 取少量黄色溶液A置于小试管中,滴入一滴酸性高锰酸钾溶液 |
酸性高锰酸钾溶液褪色,则黄色溶液A有Fe2+ 酸性高锰酸钾溶液褪色,则黄色溶液A有Fe2+ |
| ② | 检验绿色溶液C中是否含有Fe3+ | 取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液 取少量绿色溶液C置于小试管中,滴入一滴KSCN溶液 |
溶液出现血红色,则绿色溶液C仍有Fe3+ 溶液出现血红色,则绿色溶液C仍有Fe3+ |
纯铜
纯铜
.(6)采用排液法收集氯气,该液体是
饱和食盐水
饱和食盐水
,原因Cl2在饱和食盐水中溶解度较小
Cl2在饱和食盐水中溶解度较小
.