摘要:(一)必考题 26.如图16是工业生产硝酸铵的流程示意图. (1)吸收塔C中通入过量空气的目的是 .A.B.C.D四个容器中的反应.属于氧化还原反应的是 . (2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ,△H= 一1266.8kJ/mol N2(g)+O2,△H= +180.5 kJ/mol 据此写出氨高温催化氧化的热化学方程式: . 若上述催化氧化过程转移了5mol电子.则反应的能量变化为 kJ. (3)在化工研究中.经常要判断反应能否自发进行.若某反应的△H<0.则该反应是否一定能自发进行? (4)已知:N2(g)+3H2(g) 2NH3(g),△H= 一92 kJ/mol. 为提高氢气的转化率.宜采取的措施有 . A.适当升高温度 B.使用更有效的催化剂 C.增大压强 D.循环利用和不断补充氮气 E.及时分离出氨气 (5)在一定温度和压强下.将H2和N2按3∶1的体积比在密闭容器中混合.当反应达到平衡时.测得平衡混合气中NH3的体积分数为20.0%.此时H2的转化率为 . 27.A.D.E.G四种单质和X. Y.Z三种化合物均是中学化学中的重要物质.他们之间有如图17所示的转化关系.常温常压下.X是无色无味的液体.Y是黑色晶体.Z的水溶液是一种弱酸.反应(1)不能在玻璃仪器中进行.请回答下列问题: (1)X的电子式 , 的化学方程式 , (3)过量的G单质投入某稀HN03溶液中加热.放 出NO气体.写出这一反应的离子方程式 . 所得溶液中加入过量NaOH溶液.观察到的实验现象是 ; (5)将单质G与金属Al用导线连接插入盛有足量NaOH溶液的同一烧杯中.在外线路中测得有电流产生.请写出该原电池负极的电极反应式: . 28. 某校研究性学习小组探究Cu的常见化合物性质.过程如下: [提出问题] ① 在周期表中.Cu.Al位置接近.Al(OH)3具有两性.Cu(OH)2也具有两性吗? ② 通常情况下.+2价Fe的稳定性小于+3价Fe.+1价Cu的稳定性也小于+2价Cu吗? ③ CuO有氧化性.能被H2.CO等还原.也能被NH3还原吗? [实验方案] (1)解决问题①.进行相关实验时.需用到的药品有CuSO4溶液.盐酸. . (2)解决问题②的实验步骤和现象如下:取98 g Cu(OH)2固体.加热至 80 ℃-100 ℃时.得到黑色固体粉末.继续加热到1000 ℃以上.黑色粉末全部变成红色粉末A.冷却后称量.A的质量为72 g.向A中加入适量的稀硫酸.得到蓝色溶液.同时观察到容器中还有红色固体存在.A的化学式为 . (3)为解决问题③.设计的实验装置为(夹持及尾气处理装置未画出):实验中观察到CuO变为红色物质.查资料可知.同时生成一种无污染的气体.该气体的化学式为 . [实验结论] I.Cu(OH)2具有两性.证明Cu(OH)2具有两性的实验现象是 . II.根据实验方案(2).得出的+1价Cu和+2价Cu稳定性大小的结论是:高温时 稳定,在酸性溶液中 稳定. III.CuO能够被NH3还原. [问题讨论] 有同学认为NH3与CuO反应后生成的红色物质是Cu.也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物.请你设计一个简单的实验检验NH3与CuO反应后生成的红色物质中是否含有A?
网址:http://m.1010jiajiao.com/timu3_id_433681[举报]
(2013?临沭县模拟)镉离子(Cd2+)是重金属冶炼工业污水中的一种离子.处理含镉废水常用化学沉淀法.回答下面的问题.
(1)以下是几种镉的难溶化合物的溶度积常数(25℃):
根据上表提供的信息判断,沉淀Cd2+效果最佳的试剂是
a.Na2CO3 b.Na2S c.CaO
(2)如图1所示为某化工厂处理含Cd2+废水的流程:
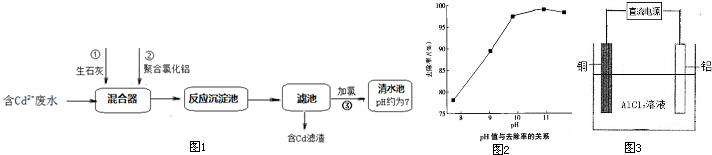
①写出加入生石灰后发生反应的离子方程式:
②聚合氯化铝[Al2(OH)nClx-n]是一种无机高分子聚合物,分子式中x=
③如图2是随污水的pH升高Cd2+去除率的变化图象,由图象可知,处理含Cd2+污水的最佳pH=
(3)在特定的电解槽中,用铝、铜作电极,氯化铝作电解液,制备聚合氯化铝(示意图如图3),电解反应为:Al+H2O+AlCl3
[Al2(OH)nClx-n]+H2
①铝作电解池的
②该电解池的阴极电极反应为
查看习题详情和答案>>
(1)以下是几种镉的难溶化合物的溶度积常数(25℃):
| 含镉难溶物 | CdCO3 | CdS | Cd(OH)2 |
| 溶度积常数 | 5.2×10-12 | 3.6×10-29 | 2.0×10-16 |
b
b
a.Na2CO3 b.Na2S c.CaO
(2)如图1所示为某化工厂处理含Cd2+废水的流程:

①写出加入生石灰后发生反应的离子方程式:
CaO+H2O=Ca2++2OH-、Cd2++2OH-=Cd(OH)2↓
CaO+H2O=Ca2++2OH-、Cd2++2OH-=Cd(OH)2↓
.②聚合氯化铝[Al2(OH)nClx-n]是一种无机高分子聚合物,分子式中x=
6
6
.③如图2是随污水的pH升高Cd2+去除率的变化图象,由图象可知,处理含Cd2+污水的最佳pH=
11
11
(取正整数),此时溶液中c(Cd2+)=2.0×10-10 mol?L-1
2.0×10-10 mol?L-1
.(3)在特定的电解槽中,用铝、铜作电极,氯化铝作电解液,制备聚合氯化铝(示意图如图3),电解反应为:Al+H2O+AlCl3
| 通电 |
①铝作电解池的
阳
阳
(填“阴”或“阳”)极.②该电解池的阴极电极反应为
2H++2e-=H2↑
2H++2e-=H2↑
.(2011?济南一模)(实验班必做,平行班选作)

甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).
(1)分析该反应并回答下列问题:
①平衡常数的表达式为K=
.
②下列各项中,不能说明该反应已经达到平衡的是
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.恒温、恒容条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1mol CO,同时生成1mol CH3OH
(2)如图1是该反应在不同温度下CO的转化率随时间变化的曲线.该反应的△H
a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He(g),使压强增大
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-a kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-b kJ?mol-1
③H2O(g)=H2O(l)△H=-c kJ?mol-1
则CH3OH(l)和O2生成CO和H2O(l)的热化学方程式是:
(4)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图2所示.该电池工作时,b口通入的物质是
(5)以上述电池做电源,用如图3所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):
查看习题详情和答案>>

甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)?CH3OH(g).
(1)分析该反应并回答下列问题:
①平衡常数的表达式为K=
| c(CH3OH) |
| c(CO)?c2H(2) |
| c(CH3OH) |
| c(CO)?c2H(2) |
②下列各项中,不能说明该反应已经达到平衡的是
d
d
(填字母编号).a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.恒温、恒容条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1mol CO,同时生成1mol CH3OH
(2)如图1是该反应在不同温度下CO的转化率随时间变化的曲线.该反应的△H
<
<
0(填“>”、“<”或“=”);T1和T2温度下的平衡常数大小关系是K1>
>
K2(填“>”、“<”或“=”).若容器容积不变,下列措施可增加甲醇产率的是b
b
(填字母编号).a.升高温度 b.将CH3OH(g)从体系中分离
c.使用合适的催化剂 d.充入He(g),使压强增大
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-a kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)△H=-b kJ?mol-1
③H2O(g)=H2O(l)△H=-c kJ?mol-1
则CH3OH(l)和O2生成CO和H2O(l)的热化学方程式是:
2CH3OH(1)+2O2(g)=2CO(g)+4H2O(l)△H=-(a+4c-b)kJ?mol-1
2CH3OH(1)+2O2(g)=2CO(g)+4H2O(l)△H=-(a+4c-b)kJ?mol-1
.(4)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出自呼吸电池及主动式电堆.甲醇燃料电池的工作原理如图2所示.该电池工作时,b口通入的物质是
甲醇
甲醇
,正极上的电极反应式为O2+4H++4e-=2H2O
O2+4H++4e-=2H2O
.(5)以上述电池做电源,用如图3所示装置,在实验室中模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用相关的电极反应式和离子方程式表示):
Al-3e-=Al3+,Al3++3HCO3-=Al(OH)3↓+CO2↑
Al-3e-=Al3+,Al3++3HCO3-=Al(OH)3↓+CO2↑
.如图1是煤化工产业链的一部分,试运用所学知识,解决下列问题:

(1)已知该产业链中某反应的平衡表达式为:K=
它所对应的化学反应为:
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+CO2(g)?2CO(g),K1 ①
CO(g)+H2O(g)?H2(g)+CO2(g),K2 ②
C(s)+H2O(g)?CO(g)+H2(g),K3 ③
则K1、K2、K3,之间的关系是:
反应①的平衡常数K随温度的升高而
一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
简述理由:
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图2所示.下列说法正确的是
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N2O4、NO2的量),反应速率v与时间t关系如右图所示.图中t4时引起平衡移动的条件可能是
查看习题详情和答案>>

(1)已知该产业链中某反应的平衡表达式为:K=
| [H2][CO] |
| [H2O] |
它所对应的化学反应为:
C(s)+H2O(g)?CO(g)+H2(g)
C(s)+H2O(g)?CO(g)+H2(g)
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+CO2(g)?2CO(g),K1 ①
CO(g)+H2O(g)?H2(g)+CO2(g),K2 ②
C(s)+H2O(g)?CO(g)+H2(g),K3 ③
则K1、K2、K3,之间的关系是:
K3=K1×K2
K3=K1×K2
.反应①的平衡常数K随温度的升高而
增大
增大
(增大/减小/不变).一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示.请填写表中相应的空格.
| 容器编号 | n(C)mol | n(H2O)mol | n(CO)mol | n(H2)mol | v正、v逆比较 |
| Ⅰ | 0.2 | 0.12 | 1.20 | 0.20 | v正=v逆 |
| Ⅱ | 0.16 | 0.20 | 0.40 | 0.80 | v正 > > v逆 |
Q=
=0.8<1=K,Q<K 平衡向正方向进行,所以v正>v逆
| 0.2×0.4 |
| 0.1 |
Q=
=0.8<1=K,Q<K 平衡向正方向进行,所以v正>v逆
| 0.2×0.4 |
| 0.1 |
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图2所示.下列说法正确的是
D
D
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N2O4、NO2的量),反应速率v与时间t关系如右图所示.图中t4时引起平衡移动的条件可能是
增大压强
增大压强
;图中表示平衡混合物中NO2的含量最高的一段时间是t3~t4
t3~t4
.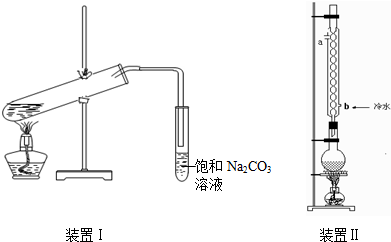 如图装置Ⅰ是实验室制乙酸乙酯的常用装置:
如图装置Ⅰ是实验室制乙酸乙酯的常用装置:(装置1大试管口是否要加橡胶塞)
实验中所用的某些试剂及产物的相关数据如下:
| 物 质 | 2,4,6 熔点/℃ |
沸点/℃ | 密度/g?cm-3 |
| 乙 醇 | -114 | 78 | 0.789 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.900 |
| 98%H2SO4 | 10 | 338 | 1.84 |
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式(在反应物和生成物中标出18O的位置)
(2)要从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因:
铝是国民经济发展的重要材料,铝在地壳中的含量约占8% ,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(I )实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:
方案3 : o
o
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案_____________________。
(II)工业上冶炼铝的流程图如图16所示:

在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe203质量分数的数据如下:
|
|
Al2O3 |
Fe2O3 |
其他杂质 |
|
铝土矿 |
55% |
16% |
— |
|
赤泥 |
15% |
48% |
一 |
(1) 书写化学方程式,反应①_________,反应②________________
(2) 电解氧化铝生产铝时,阳极的电极反应式为________________。
(3) 假设其它杂质不参加反应,则每生产3.4t纯净的氧化铝,需铝土矿________t
查看习题详情和答案>>