网址:http://m.1010jiajiao.com/timu3_id_433603[举报]
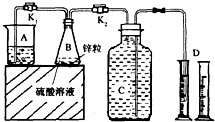 某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如下表:
某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气.不同条件下,每分钟收集到氢气的体积如下表:| 实验序号 | 硫酸浓度 | 饱和硫酸铜溶液体积/mL | 反应达到平稳的时间/min | 第1分钟收集氢气体积/mL | 第2分钟收集氢气体积/mL | 第3分钟收集氢气体积/mL | … |
| 1 | 20% | 0 | 5.4 | 6.1 | 11.9 | 13.7 | … |
| 2 | 20% | 0.5 | 2.5 | 23.9 | 32.1 | 33.5 | … |
| 3 | 30% | 0.5 | 1.1 | 60.7 | 89.9 | 90.1 | … |
| 4 | a% | 3.0 | 0.8 | 55.7 | 66.0 | 61.4 | … |
(1)关闭K2、打开K1,观察到
(2)实验l、2是对比探究实验,分析上表,说明该对比探究实验的目的是
(3)细口瓶C的容积为V(mL),为了使加入的锌(质量bg)不浪费,在C中还留有
| 2 |
| 5 |
(4)实验4是研究饱和硫酸铜溶液的体积对实验的影响,a值应为
A. 20 B.30 C.27 D. 40
(5)分析上表,市售锌粒和硫酸反应制取氢气的条件应该选择实验
(6)从实验后的废液中回收皓矾(ZnSO4?7H2O)所需的实验操作步骤是
(7)查资料得知:Cu++Cl-═CuCl↓.
湿法冶锌工艺中,硫酸锌溶液中常含有少量的氯离子,往其中加硫酸铜溶液和金属锌,可除去氯离子,其离子反应方程式是
| A、每一周期的元素都从碱金属开始,最后以稀有气体结束 | B、同一周期中(除第一周期外),从左到右,各元素最外层电子数都是从1个逐步增加到8个 | C、第二、三周期上下相邻的元素的原子核外电子数相差8个 | D、第七周期只有23种元素 |
(1)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能的杂质是__________。它是由________________而产生的。如果滤液中该杂质的含量不是很低,其检测方法是________________________________。
(2)设Na2SO3跟硫粉完全反应,将滤液蒸发浓缩后,冷却至70 ℃,溶液的体积约为30 mL,该溶液是否达到饱和?试通过计算说明。(70 ℃时,Na2S2O3饱和溶液的密度为1.17 g·cm-3)
(3)若要计算在100 ℃下将溶液蒸发至体积为30.0 mL,再冷却至10 ℃所能得到的Na2S2O3·5H2O的质量,你认为__________(填写1个选项字母)。
A.前面提供的数据已经足够
B.还需要提供100 ℃时溶液的密度(1.14 g·cm-3)
C.还需提供结晶后剩余溶液体积(10.0 mL)
(4)根据第(3)小题的选择(如选A项则直接计算,如选B项或C项则可选用其数据计算),计算从10 ℃ 30.0 mL溶液中结晶析出的Na2S2O3·5H2O质量。
查看习题详情和答案>>在元素周期表中
【小题1】周期表中共有_______个纵行,若每个纵行称作1列,则VA族是第____列。
ⅡA族后面是第_______族。所含元素的种类最多的是____________族;
【小题2】 同一周期,从左向右,原子半径逐渐_____________,金属性逐渐__________;
【小题3】同一主族,从上到下,原子半径逐渐_____________,还原性逐渐__________;
【小题4】 同一元素的阴离子半径________相应的原子半径,电子层结构相同的离子,
核电荷数越多,半径越__________。
用废铁屑与稀硫酸反应,可制得硫酸亚铁。在100C和500C时,FeSO4在 100 g水中的溶解度分别为20.5 g和 48.6g.常温下,从溶液中析出的晶体是FeSO4?7H2O。现取 200 ml 0.500 mol/L H2SO4溶液,将 8.00 g废铁屑加入到上述稀H2SO4中,并不断搅拌,反应约 15 min后过滤。滤液在80℃经蒸发、浓缩,冷却至10℃后析出FeSO4?7H2O晶体。
(1)若加入的废铁不是粉状而是块状,对反应的影响是 。
A.会降低反应速率 B.会减少绿矾产量
C.需要加热才反应 D.将增大反应体系的PH值
(2)反应 15 min后过滤,其目的是 。
(3)滤液中除 FeSO4和可能未反应完全的H2SO4外,最可能存在的无机杂质是 。它是由 而产生的,其检测的方法是 。
(4)设 H2SO4与铁完全反应,当将滤液蒸发浓缩后,冷却至 500C时,溶液的体积约为50.0 ml,该溶液是否达饱和?试通过计算加以说明。(500C时,FeSO4饱和溶液的密度为1.36 g/cm3)
(5)若要计算在800C下将溶液蒸发至体积为70.0 ml,再冷却至100C时,所得到的FeSO4 ?7H2O的质量,你认为 (填编号),并简述所选之理由。答 。
A.前面提供的数据已经足够
B.还需要提供 100C时饱和溶液的密度: 1.42 g/cm3
C.还需要提供 800C时溶液的密度:1.30 g/cm3
D.还需要提供结晶后剩余溶液的体积:52.0 ml
(6)根据第(5)小题你的选择项(如选A则直接计算,如选B、C或D则可选用其数据)计算从100C 50.0 ml溶液中结晶析出的FeSO4?7H2O的质量。(本大题计算结果保留3位有效数字)
查看习题详情和答案>>