题目内容
用废铁屑与稀硫酸反应,可制得硫酸亚铁。在100C和500C时,FeSO4在 100 g水中的溶解度分别为20.5 g和 48.6g.常温下,从溶液中析出的晶体是FeSO4?7H2O。现取 200 ml 0.500 mol/L H2SO4溶液,将 8.00 g废铁屑加入到上述稀H2SO4中,并不断搅拌,反应约 15 min后过滤。滤液在80℃经蒸发、浓缩,冷却至10℃后析出FeSO4?7H2O晶体。
(1)若加入的废铁不是粉状而是块状,对反应的影响是 。
A.会降低反应速率 B.会减少绿矾产量
C.需要加热才反应 D.将增大反应体系的PH值
(2)反应 15 min后过滤,其目的是 。
(3)滤液中除 FeSO4和可能未反应完全的H2SO4外,最可能存在的无机杂质是 。它是由 而产生的,其检测的方法是 。
(4)设 H2SO4与铁完全反应,当将滤液蒸发浓缩后,冷却至 500C时,溶液的体积约为50.0 ml,该溶液是否达饱和?试通过计算加以说明。(500C时,FeSO4饱和溶液的密度为1.36 g/cm3)
(5)若要计算在800C下将溶液蒸发至体积为70.0 ml,再冷却至100C时,所得到的FeSO4 ?7H2O的质量,你认为 (填编号),并简述所选之理由。答 。
A.前面提供的数据已经足够
B.还需要提供 100C时饱和溶液的密度: 1.42 g/cm3
C.还需要提供 800C时溶液的密度:1.30 g/cm3
D.还需要提供结晶后剩余溶液的体积:52.0 ml
(6)根据第(5)小题你的选择项(如选A则直接计算,如选B、C或D则可选用其数据)计算从100C 50.0 ml溶液中结晶析出的FeSO4?7H2O的质量。(本大题计算结果保留3位有效数字)
(1)AB (2分)(2)除去过量的铁屑(1分)(3) Fe2(SO4)3 ;废铁屑中含有氧化生成Fe2O3(或Fe3O4)被H2SO4溶解生成Fe2(SO4)3。FeSO4被空气氧化生成Fe2(SO4)3;取少许滤液,加KSCN溶液,观察溶液是否变血红色。(3分)
(4)解法一:若反应后得到的FeSO4在50℃时配成饱和溶液,其体积为x则,
x=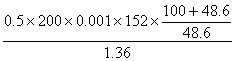 ==34.17(mL)<50mL
==34.17(mL)<50mL
所以,蒸发后溶液尚未饱和. (3分)
解法二:若该溶液是饱和的,则其所含的 FeSO4溶质的质量为y 则
y==50×1.36×![]() ==22.24(g)
==22.24(g)
按题意 H2SO4完全反应得到的 FeSO4的质量为:
0.5 × 200 ×10-3 ×152 =15.2
因 15.2g<22.24 g,则溶液尚未达到饱和.
(5)C;(4)中求证 50℃时溶液饱和否,涉及溶解度的计算.用到了1.36 g/cm3
(50℃时)的密度数据。同理,涉及 80℃时溶解度的计算也要用到 80℃时对应的溶液的密度数据。(3分)
(6)(3分)解法一:
①(5)中所给 80℃时 50.0 ml溶液中含溶剂水的质量为:
50.0ml ×1.30g/cm3―15.2g=49.8g
②设析出的FeSO4?7H2O的质量为X,则可列出
![]() =
=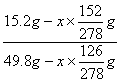 x=11.0g
x=11.0g
解法二:
10℃,饱和溶液中FeSO4的质量分数=![]() ×100%=17.0%
×100%=17.0%
则(50.0×1.30-x)×![]() + x×
+ x×![]() =15.2
=15.2
x=11.0 (g)

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
| |||||||||||||||||||||||||||||||||||||||||||||||
(1)铁屑表面少量的铁锈对制取硫酸亚铁有无影响______(填“有”或“无”.其原因是______,该步实验的关键是保证______过量(填“硫酸”或“铁屑”);
(2)FeSO4在不同温度下溶解度如下表所示:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
| 溶解度/g/100g水 | 18.5 | 20.8 | 26.3 | 32.8 | 40.1 | 48.4 | 52.4 | 50.9 | 43.7 |
(A)冷却 (B)蒸发
(C)结晶 (D)洗涤 (E)过滤
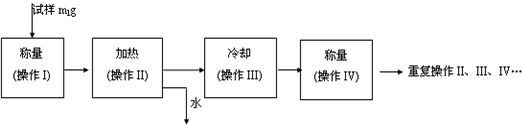
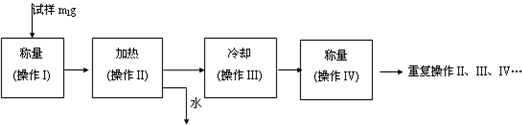
(3)以下是测定FeSO4?xH2O中结晶水含量的实验流程.(称量仪器为电子天平)
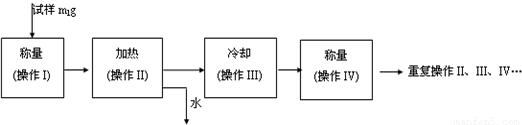
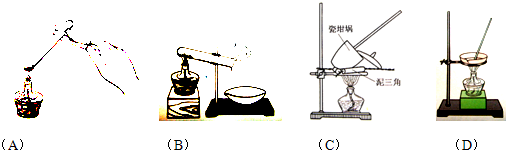
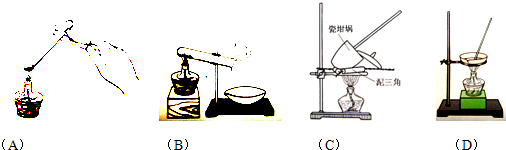
①其加热装置正确的是______
②重复操作II、III、IV,直到连续两次称量结果相差不超过______g;
③操作III必须要在______中(填仪器名称)进行.
(4)以下结晶水含量测定操作正确的是______;
A、加热时,晶体溅出坩埚,再加些FeSO4?xH2O
B、加热时,先用小火,后用大火加热至最后
C、加热时,不断用玻璃棒搅拌
D、恒重操作是指加热、冷却、称量这一过程重复两次
(5)实验中出现下列情况时,将对X值有何影响(填“偏大”、“偏小”或“无影响”):灼烧时有黑色固体出现______;在冷却过程中,无水硫酸亚铁又吸收了空气中的水蒸气______.