摘要: SO32-+ H2O HSO3-+OH- 2分 (2)②假设1:Na2S 和Na2SO4 , 2分 假设2:Na2S. Na2SO3 和Na2SO4. 2分 ③ 实验步骤 预期现象和结论 步骤2:往试管中.加入足量6 mol·L-1 HCl 若溶液变浑浊.则说明固体中含有Na2S和Na2SO3,若溶液没有变浑浊.而仅有有特殊气味的气体放出.说明固体中含有Na2S 步骤3:取步骤2中的澄清液于试管.然后往试管中加入少量0.1 mol·L-1 BaCl2 若有白色沉淀生成.则说明固体中含有Na2SO4.结合步骤2.若溶液没有变浑浊.只有气体放出.则假设1成立,若溶液变浑浊.则假设2成立.
网址:http://m.1010jiajiao.com/timu3_id_433484[举报]
如图是元素周期表的一部分,针对表中的①至⑩号元素,请按照要求回答以下问题.
(1)①至⑩号元素形成的气态氢化物中最稳定的是
(2)元素②和⑨,非金属性较强的是
(3)均由①④⑥⑨四种元素组成的两种化合物发生反应,能产生一种气体,该反应的化学方程式是:
(4)元素④的某一种氢化物常温下呈液态(每个分子由18个电子),将该氢化物滴到氯化亚铁溶液中,溶液的颜色发生明显变化,请写出该反应的离子方程式:
(5)元素⑥和⑨组成的化合物溶于水,溶液呈
(6)能说明非金属性⑤比⑩强的是
A.单质与氢气化合,⑤比⑩容易; B.最高价氧化物对应的水化物的酸性,⑤比⑩强;
C.气态氢化物的稳定性,⑤比⑩强; D.单质⑤能在水溶液中置换出单质⑩.
(7)元素⑧与⑩形成的化合物有两种,其中一种化合物各原子最外层均达到了8电子的稳定结构,该化合物的化学式为
查看习题详情和答案>>
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
HF
HF
(填氢化物的化学式);(2)元素②和⑨,非金属性较强的是
硫
硫
(填元素名称),请用一个离子方程式来说明这个结论:CO32-+2H+═H2O+CO2↑或HCO3-+H+═H2O+CO2↑
CO32-+2H+═H2O+CO2↑或HCO3-+H+═H2O+CO2↑
;(3)均由①④⑥⑨四种元素组成的两种化合物发生反应,能产生一种气体,该反应的化学方程式是:
NaHSO3+NaHSO4═Na2SO4+H2O+SO2↑
NaHSO3+NaHSO4═Na2SO4+H2O+SO2↑
;(4)元素④的某一种氢化物常温下呈液态(每个分子由18个电子),将该氢化物滴到氯化亚铁溶液中,溶液的颜色发生明显变化,请写出该反应的离子方程式:
2Fe2++H2O2+2H+═2Fe3++2H20
2Fe2++H2O2+2H+═2Fe3++2H20
;(5)元素⑥和⑨组成的化合物溶于水,溶液呈
碱性
碱性
(填“酸性”、“中性”或“碱性”),其原因是S2-+H2O?HS-+OH-
S2-+H2O?HS-+OH-
(用离子方程式表达),溶液中的各种离子按照浓度由大到小排列顺序是:Na+>S2->OH->HS->H+
Na+>S2->OH->HS->H+
.(6)能说明非金属性⑤比⑩强的是
AC
AC
.A.单质与氢气化合,⑤比⑩容易; B.最高价氧化物对应的水化物的酸性,⑤比⑩强;
C.气态氢化物的稳定性,⑤比⑩强; D.单质⑤能在水溶液中置换出单质⑩.
(7)元素⑧与⑩形成的化合物有两种,其中一种化合物各原子最外层均达到了8电子的稳定结构,该化合物的化学式为
PCl3
PCl3
.脱硫技术能有效控制SO2对空气的污染.
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是
(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、HCO3-等离子.含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:

①向曝气池中通入空气的目的是
②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是
a.Cl- b.SO42- c.Br- d.HCO3-
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示.(电极材料为石墨)

①图中a极要连接电源的(填“正”或“负”)
②SO32-放电的电极反应式为
③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因
查看习题详情和答案>>
(1)向煤中加入石灰石可减少燃烧产物中SO2的含量,该反应的化学方程式是
2SO2+O2+2CaCO3=2CaSO4+2CO2
2SO2+O2+2CaCO3=2CaSO4+2CO2
.(2)海水呈弱碱性,主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、HCO3-等离子.含SO2的烟气可利用海水脱硫,其工艺流程如下图所示:

①向曝气池中通入空气的目的是
将H2SO3、HSO3-等氧化为SO42-
将H2SO3、HSO3-等氧化为SO42-
.②通入空气后曝气池中海水与天然海水相比,浓度有明显不同的离子是
bd
bd
.a.Cl- b.SO42- c.Br- d.HCO3-
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示.(电极材料为石墨)

①图中a极要连接电源的(填“正”或“负”)
负
负
极,C口流出的物质是硫酸
硫酸
.②SO32-放电的电极反应式为
SO32--2e-+H2O=SO42-+2H+
SO32--2e-+H2O=SO42-+2H+
.③电解过程中阴极区碱性明显增强,用平衡移动原理解释原因
H2O?H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强
H2O?H++OH-,在阴极H+放电生成H2,c(H+)减小,水的电离平衡正向移动,碱性增强
.下列表示化学过程的化学式书写正确的是:
A.亚硫酸钠溶液显碱性:SO32-+2 H2O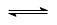 H2SO3 +2 OH-
H2SO3 +2 OH-
B.氯化银投入水中后建立平衡:AgCl (s) 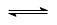 Ag+ (aq) + Cl-(aq)
Ag+ (aq) + Cl-(aq)
C.甲烷的燃烧热为890.3kJ·mol-1,表示甲烷燃烧热的热化学方程式为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
D.500℃、30MPa下,将0.5mol
N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)
 2NH3(g) △H=-38.6 kJ·mol-1
2NH3(g) △H=-38.6 kJ·mol-1
查看习题详情和答案>>