题目内容
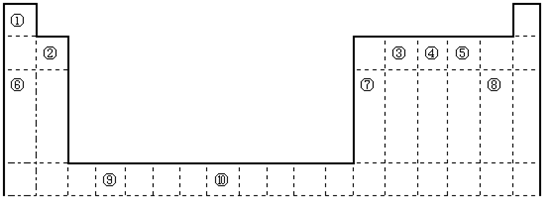
如图是元素周期表的一部分,针对表中的①至⑩号元素,请按照要求回答以下问题.
(1)①至⑩号元素形成的气态氢化物中最稳定的是
(2)元素②和⑨,非金属性较强的是
(3)均由①④⑥⑨四种元素组成的两种化合物发生反应,能产生一种气体,该反应的化学方程式是:
(4)元素④的某一种氢化物常温下呈液态(每个分子由18个电子),将该氢化物滴到氯化亚铁溶液中,溶液的颜色发生明显变化,请写出该反应的离子方程式:
(5)元素⑥和⑨组成的化合物溶于水,溶液呈
(6)能说明非金属性⑤比⑩强的是
A.单质与氢气化合,⑤比⑩容易; B.最高价氧化物对应的水化物的酸性,⑤比⑩强;
C.气态氢化物的稳定性,⑤比⑩强; D.单质⑤能在水溶液中置换出单质⑩.
(7)元素⑧与⑩形成的化合物有两种,其中一种化合物各原子最外层均达到了8电子的稳定结构,该化合物的化学式为
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | ⑤ | ||||
| 三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
HF
HF
(填氢化物的化学式);(2)元素②和⑨,非金属性较强的是
硫
硫
(填元素名称),请用一个离子方程式来说明这个结论:CO32-+2H+═H2O+CO2↑或HCO3-+H+═H2O+CO2↑
CO32-+2H+═H2O+CO2↑或HCO3-+H+═H2O+CO2↑
;(3)均由①④⑥⑨四种元素组成的两种化合物发生反应,能产生一种气体,该反应的化学方程式是:
NaHSO3+NaHSO4═Na2SO4+H2O+SO2↑
NaHSO3+NaHSO4═Na2SO4+H2O+SO2↑
;(4)元素④的某一种氢化物常温下呈液态(每个分子由18个电子),将该氢化物滴到氯化亚铁溶液中,溶液的颜色发生明显变化,请写出该反应的离子方程式:
2Fe2++H2O2+2H+═2Fe3++2H20
2Fe2++H2O2+2H+═2Fe3++2H20
;(5)元素⑥和⑨组成的化合物溶于水,溶液呈
碱性
碱性
(填“酸性”、“中性”或“碱性”),其原因是S2-+H2O?HS-+OH-
S2-+H2O?HS-+OH-
(用离子方程式表达),溶液中的各种离子按照浓度由大到小排列顺序是:Na+>S2->OH->HS->H+
Na+>S2->OH->HS->H+
.(6)能说明非金属性⑤比⑩强的是
AC
AC
.A.单质与氢气化合,⑤比⑩容易; B.最高价氧化物对应的水化物的酸性,⑤比⑩强;
C.气态氢化物的稳定性,⑤比⑩强; D.单质⑤能在水溶液中置换出单质⑩.
(7)元素⑧与⑩形成的化合物有两种,其中一种化合物各原子最外层均达到了8电子的稳定结构,该化合物的化学式为
PCl3
PCl3
.分析:由元素在周期表中的位置可知①为H元素,②为C元素,③为N元素,④为O元素,⑤为F元素,⑥为Na元素,⑦为Si元素,⑧为P元素,⑨为S元素,⑩为Cl元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答:解:由元素在周期表中的位置可知①为H元素,②为C元素,③为N元素,④为O元素,⑤为F元素,⑥为Na元素,⑦为Si元素,⑧为P元素,⑨为S元素,⑩为Cl元素,
(1)非金属最强的为F,对应的氢化物HF的稳定性最强,
故答案为:HF;
(2)②为C元素,⑨为S元素,由对应的最高价氧化物的水化物的酸性硫酸比碳酸强可知非金属性较强的为硫元素,根据强酸制备弱酸的原理可知反应的离子方程式可为CO32-+2H+═H2O+CO2↑或HCO3-+H+═H2O+CO2↑,
故答案为:硫;CO32-+2H+═H2O+CO2↑或HCO3-+H+═H2O+CO2↑; (3)均由①④⑥⑨四种元素组成的两种化合物可分别为NaHSO3、NaHSO4,二者反应的方程式为NaHSO3+NaHSO4═Na2SO4+H2O+SO2↑,
故答案为:NaHSO3+NaHSO4═Na2SO4+H2O+SO2↑;
(4)④为O元素,对应的某一种氢化物常温下呈液态(每个分子由18个电子),应为H2O2,具有氧化性,与氯化亚铁反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H20,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H20;
(5)元素⑥和⑨组成的化合物为Na2S,为强碱弱酸盐,水解呈碱性,发生S2-+H2O?HS-+OH-,溶液中离子浓度大小关系为 Na+>S2->OH->HS->H+,
故答案为:碱性;S2-+H2O?HS-+OH-; Na+>S2->OH->HS->H+;
(6)F无正价,证明非金属性的强弱,可根据单质与氢气反应的剧烈程度以及氢化物的稳定性,氟气与水剧烈反应,不能置换出氯气,
故答案为:AC;
(7)⑧为P元素,⑩为Cl元素,化合物各原子最外层均达到了8电子的稳定结构,应为PCl3,
故答案为:PCl3.
(1)非金属最强的为F,对应的氢化物HF的稳定性最强,
故答案为:HF;
(2)②为C元素,⑨为S元素,由对应的最高价氧化物的水化物的酸性硫酸比碳酸强可知非金属性较强的为硫元素,根据强酸制备弱酸的原理可知反应的离子方程式可为CO32-+2H+═H2O+CO2↑或HCO3-+H+═H2O+CO2↑,
故答案为:硫;CO32-+2H+═H2O+CO2↑或HCO3-+H+═H2O+CO2↑; (3)均由①④⑥⑨四种元素组成的两种化合物可分别为NaHSO3、NaHSO4,二者反应的方程式为NaHSO3+NaHSO4═Na2SO4+H2O+SO2↑,
故答案为:NaHSO3+NaHSO4═Na2SO4+H2O+SO2↑;
(4)④为O元素,对应的某一种氢化物常温下呈液态(每个分子由18个电子),应为H2O2,具有氧化性,与氯化亚铁反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H20,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H20;
(5)元素⑥和⑨组成的化合物为Na2S,为强碱弱酸盐,水解呈碱性,发生S2-+H2O?HS-+OH-,溶液中离子浓度大小关系为 Na+>S2->OH->HS->H+,
故答案为:碱性;S2-+H2O?HS-+OH-; Na+>S2->OH->HS->H+;
(6)F无正价,证明非金属性的强弱,可根据单质与氢气反应的剧烈程度以及氢化物的稳定性,氟气与水剧烈反应,不能置换出氯气,
故答案为:AC;
(7)⑧为P元素,⑩为Cl元素,化合物各原子最外层均达到了8电子的稳定结构,应为PCl3,
故答案为:PCl3.
点评:本题考查无机物的推断以及元素周期表与周期律的综合应用,为高考常见题型,侧重于学生的分析能力和推断能力的考查,题目考查角度较多,难度中等,注意基础知识的连接掌握.

练习册系列答案
相关题目
 如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )
如图是元素周期表的一部分,X、Y、Z、W均为短周期元素,X、Z的质子数之和为21.下列说法正确的是( )| A、X元素最多可形成六种氧化物 | B、Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 | C、X元素的非金属性比Y元素非金属性强 | D、Z和X能以共价键结合形成一种无机非金属材料 |