网址:http://m.1010jiajiao.com/timu3_id_433482[举报]
《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
| A.基态原子中不一定都有未成对的电子 |
| B.由极性键形成的分子一定是极性分子 |
| C.晶格能大小顺序:NaCl > KCl |
| D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子 |
19-2.(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 。
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。

则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。 查看习题详情和答案>>
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是 ( )
| A.基态原子中不一定都有未成对的电子 |
| B.由极性键形成的分子一定是极性分子 |
| C.晶格能大小顺序:NaCl > KCl |
| D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子 |
19-2.(14分)四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 基态原子核外有两个电子层,最外层有3个未成对的电子 | 基态原子的M层有1对成对的p电子 | 基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点 (填“高”或“低”),其原因是 。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点 (填“高”或“低”),其原因是 。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为 ,简要描述该配合物中化学键的成键情况 。
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。
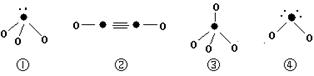
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写序号);在②的分子中有 个σ键和 个π键。
(15分)以下是元素周期表的一部分,根据给定的元素回答下列问题
(1)K的元素符号是 ;
(2)D元素的外围电子排布图是 ,在其化合物中,最高正价是 ;
(3)C元素的原子结构示意图是 ;
(4)A与L、B与L都分别能形成原子个数比为1:1的化合物,A与L(1:1)的化合物是 分子(填极性或非极性),B与L(1:1)的化合物的电子式是 ;
(5)G、H、L原子的第一电离能由高到低的顺序是 (填元素符号);
(6)J单质的一种白色同分异构体的空间构型是 ;
(7)E元素在元素周期表中的位置是 ,在其化合物中,常有+2、+3价的2种离子,+3的离子比较稳定,其原因是 ;
(8)A与B的化合物的熔点比A与L的化合物的熔点高,其原因是 ;
(9)A的单质与L的单质与B的最高价氧化物的水化物溶液能组成燃烧电池,写出该种电池的负极的电极反应式 ;
(10)F元素的最高价氧化物与M元素的最高价氧化物的水化物反应的化学方程式是
。
查看习题详情和答案>>
(15分)以下是元素周期表的一部分,根据给定的元素回答下列问题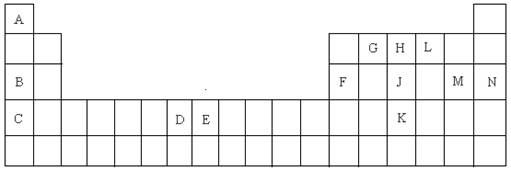
(1)K的元素符号是 ;
(2)D元素的外围电子排布图是 ,在其化合物中,最高正价是 ;
(3)C元素的原子结构示意图是 ;
(4)A与L、B与L都分别能形成原子个数比为1:1的化合物,A与L(1:1)的化合物是 分子(填极性或非极性),B与L(1:1)的化合物的电子式是 ;
(5)G、H、L原子的第一电离能由高到低的顺序是 (填元素符号);
(6)J单质的一种白色同分异构体的空间构型是 ;
(7)E元素在元素周期表中的位置是 ,在其化合物中,常有+2、+3价的2种离子,+3的离子比较稳定,其原因是 ;
(8)A与B的化合物的熔点比A与L的化合物的熔点高,其原因是 ;
(9)A的单质与L的单质与B的最高价氧化物的水化物溶液能组成燃烧电池,写出该种电池的负极的电极反应式 ;
(10)F元素的最高价氧化物与M元素的最高价氧化物的水化物反应的化学方程式是
。
(15分)以下是元素周期表的一部分,根据给定的元素回答下列问题
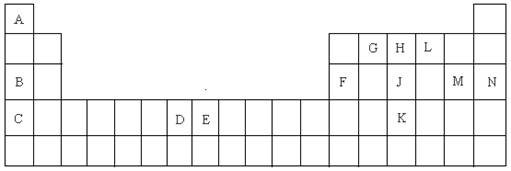
(1)K的元素符号是 ;
(2)D元素的外围电子排布图是 ,在其化合物中,最高正价是 ;
(3)C元素的原子结构示意图是 ;
(4)A与L、B与L都分别能形成原子个数比为1:1的化合物,A与L(1:1)的化合物是 分子(填极性或非极性),B与L(1:1)的化合物的电子式是 ;
(5)G、H、L原子的第一电离能由高到低的顺序是 (填元素符号);
(6)J单质的一种白色同分异构体的空间构型是 ;
(7)E元素在元素周期表中的位置是 ,在其化合物中,常有+2、+3价的2种离子,+3的离子比较稳定,其原因是 ;
(8)A与B的化合物的熔点比A与L的化合物的熔点高,其原因是 ;
(9)A的单质与L的单质与B的最高价氧化物的水化物溶液能组成燃烧电池,写出该种电池的负极的电极反应式 ;
(10)F元素的最高价氧化物与M元素的最高价氧化物的水化物反应的化学方程式是
。
查看习题详情和答案>>