网址:http://m.1010jiajiao.com/timu3_id_433470[举报]
课本实验设计得简要明了,但也常存在一些不足,在学习过程中对其进行分析与改进是研究性学习的一个重要课题。
Ⅰ.草酸晶体(H2C2O4·2H2O)受热易分解(分解温度为175℃),产生CO和CO2。关于草酸晶体受热分解及验证部分分解产物的实验装置如图。
(1)写出草酸晶体受热分解的化学方程式:
__________。
(2)设计该装置欲验证的分解产物是 。
(3)草酸晶体的某些物理性质如下表:
|
| 分子式 | 颜色、状态 | 水溶性 | 熔点/℃ | 密度/g·cm—3 |
| 草酸晶体 | H2C2O4·2H2O | 无色晶体 | 易溶于水 | 101.5 | 1.650 |
有同学认为,用该装置进行实验,存在着不合理因素,请分析指出(任答两点):
①
②
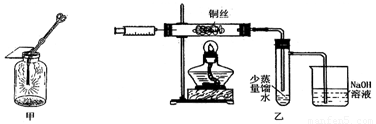
Ⅱ.下图甲是 “铜丝在氯气中燃烧”的演示实验,铜丝在氯气中燃烧的主要现象是 。有人对该实验提出了如下改进方案:
①按下图乙所示连接好装置,并检查气密性;
②取下注射器并集满Cl2;
③点燃酒精灯加热1~2min后,再移开酒精灯。迅速将注射针插入石英玻璃管内,并将Cl2缓缓推入玻璃管中;
④拔出针头,再用同样方法快速向玻璃管中推入空气。请回答:
(1)步骤③中,移开酒精灯、推入Cl2时,观察到铜丝继续保持红热状态,由此可判断,该反应为 反应(填“放热”或“吸热”)。
(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离方程式为 。
(3)改进后的实验与课本实验相比较,其优点为
______________。
查看习题详情和答案>>
课本实验设计得简要明了,但也常存在一些不足,在学习过程中对其进行分析与改进是研究性学习的一个重要课题。
Ⅰ.草酸晶体(H2C2O4·2H2O)受热易分解(分解温度为175℃),产生CO和CO2。关于草酸晶体受热分解及验证部分分解产物的实验装置如图。

(1)写出草酸晶体受热分解的化学方程式:
__________。
(2)设计该装置欲验证的分解产物是 。
(3)草酸晶体的某些物理性质如下表:
|
|
分子式 |
颜色、状态 |
水溶性 |
熔点/℃ |
密度/g·cm—3 |
|
草酸晶体 |
H2C2O4·2H2O |
无色晶体 |
易溶于水 |
101.5 |
1.650 |
有同学认为,用该装置进行实验,存在着不合理因素,请分析指出(任答两点):
①
②
Ⅱ.下图甲是 “铜丝在氯气中燃烧”的演示实验,铜丝在氯气中燃烧的主要现象是 。有人对该实验提出了如下改进方案:
①按下图乙所示连接好装置,并检查气密性;
②取下注射器并集满Cl2;
③点燃酒精灯加热1~2min后,再移开酒精灯。迅速将注射针插入石英玻璃管内,并将Cl2缓缓推入玻璃管中;
④拔出针头,再用同样方法快速向玻璃管中推入空气。请回答:
(1)步骤③中,移开酒精灯、推入Cl2时,观察到铜丝继续保持红热状态,由此可判断,该反应为 反应(填“放热”或“吸热”)。
(2)步骤④完成后,发现乙试管中的蒸馏水变为蓝绿色。此时缓缓拉动活塞,使少量NaOH溶液吸入乙试管中,看到试管中有 色的沉淀产生,该反应的离方程式为 。
(3)改进后的实验与课本实验相比较,其优点为
______________。
查看习题详情和答案>>
氧化铁是重要工业颜料。工业上通常以废铁屑(杂质不与酸反应)为原料制备FeCO3,再将其煅烧制取氧化铁。工业制备FeCO3的流程如下:
回答下列问题:
(1)操作Ⅰ的名称是 。
(2)写出生成FeCO3沉淀的离子方程式 。
(3)有些同学认为滤液Ⅰ中铁元素含量可用KMnO4溶液来测定(5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 。
②某同学设计了下列滴定方式(夹持部分略去),最合理的是 。(填字母序号)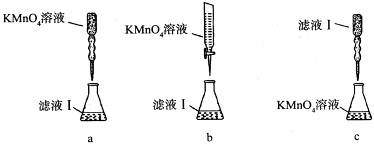
(4)该流程中用到的Na2CO3在工业生产中常含有少量NaCl。某校化学活动社团设计如图所示装置来测定Na2CO3的含量。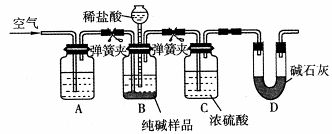
①要检验Na2CO3中杂质的存在,选用下列试剂中的 (选填序号)。
a.氢氧化钡溶液 b.稀硝酸 c.硫氰酸钾溶液 d.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后静置,若 ,说明装置不漏气。
③装置A中的试剂 ,装置C的作用 。
④以上实验装置存在明显缺陷,该缺陷导致测定结果偏高,该缺陷为 。

