摘要:10. (1)①0.0030mol·L-1·min-1 ②< 2.25×10-4 (2)④< < ⑤BC ⑥A B. 实验编号 T(℃) n (CO)/n(H2) P(MPa) ⅰ ⅱ 150 1/3 ⅲ 1/3
网址:http://m.1010jiajiao.com/timu3_id_432930[举报]
 A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题:
A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题:(1)E单质为双原子分子,气体E的密度3.17g.L-1(标准状况),写出用石灰水吸收E反应的离子方程式:
Cl2+2OH-=Cl-+ClO-+2H2O
Cl2+2OH-=Cl-+ClO-+2H2O
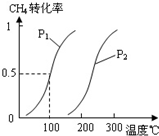
(2)由A、B、D元素原子组成的化合物CH4和H2O在一定条件下发生反应:CH4(g)+H2O(g)CO(g)+3H2(g).将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如图.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
0.0030mol?L-1?min-1
0.0030mol?L-1?min-1
.②图中的P1
<
<
P2(填“<”、“>”或“=”),100℃时平衡常数为2.25×10-4
2.25×10-4
.③在其它条件不变的情况下降低温度,逆反应速率将
减小
减小
(填“增大”、“减小”或“不变”).(3)由A、C、D元素原子组成的化合物N2H4和H2O2有广泛的用途.
①N2H4(肼)一空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液.电池放电时,负极的电极反应式为
N2H4+4OH-=N2↑+4H2O+4e-
N2H4+4OH-=N2↑+4H2O+4e-
.②已知:16g液态N2H4(肼)与足量过氧化氢反应生成氮气和水蒸气,放出320.75KJ的热量.
H2O(1)=H2O(g)△H=+44kJ?mol-1
2H2O2(1)=2H2O(1)+O2(g)△H=-196.4kJ?mol-1
写出N2H4(肼)与氧气反应的热化学方程式为
N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-621.1kJ?mol-1
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
N2H4(1)+O2(g)=N2(g)+2H2O(1)△H=-621.1kJ?mol-1
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
.或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
甲醇被称为21世纪的新型燃料,工业上通过下列反应I和Ⅱ,用CH4和H2O为原料来制备甲醇.

(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)Ⅰ
CH4的平衡转化率与温度、压强的关系如图1.①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均速率为
②图中的P1
③在其它条件不变的情况下降低温度,逆反应速率将
(2)在压强为0.1MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)Ⅱ.
④该反应的△H
⑤若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
A.请在上表空格中填入剩余的实验条件数据.
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图(如图2),并标明各曲线的压强.
查看习题详情和答案>>

(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)Ⅰ
CH4的平衡转化率与温度、压强的关系如图1.①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均速率为
0.0030mol?L-1?min-1
0.0030mol?L-1?min-1
.②图中的P1
<
<
P2(填“<”、“>”或“=”),100℃时平衡常数的值为2.25×10-4
2.25×10-4
.③在其它条件不变的情况下降低温度,逆反应速率将
减小
减小
(填“增大”“减小”或“不变”).(2)在压强为0.1MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)Ⅱ.
④该反应的△H
<
<
0,△S<
<
0(填“<”、“>”或“=”).⑤若容器容积不变,下列措施可增加甲醇产率的是
BD
BD
.A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) | ||||
| i | 150 |
|
0.1 | ||||
| ii | 150 150 |
|
5 | ||||
| iii | 350 |
|
5 |
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图(如图2),并标明各曲线的压强.
 甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:
甲醇是一种很好的燃料,工业上用CH4和H2O(g)为原料,通过反应Ⅰ和Ⅱ来制备甲醇.请回答下列问题:(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L)中,在一定条件下发生反应:
CH4(g)+H2O(g)?CO(g)+3H2(g)(Ⅰ)
CH4的转化率与温度、压强的关系如图1所示.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
0.0030mol?L-1?min-1
0.0030mol?L-1?min-1
.②图中的p1
<
<
p2(填“<”、“>”或“=”),100℃时的平衡常数为2.25×10-4
2.25×10-4
.③该反应的△H
>
>
0,△S>
>
0(填“<”、“>”或“=”).(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:
CO(g)+2H2(g)?△H<0 (Ⅱ)
①若容器的容积不变,下列措施可增大甲醇产率的是
BD
BD
(填序号).A.升高温度
B.将CH3OH(g)从体系中分离出来
C.恒容下充入He,使体系的总压强增大
D.再充入a mol CO和3a mol H2
②为了寻找合成甲醇的适宜温度和压强,某同学设计了三组实验,部分实验条件已经填在了下面的实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | ρ(MPa) | ||
| 1 | 150 |
|
0.1 | ||
| 2 | n |
|
5 | ||
| 3 | 350 | m | 5 |
150
150
,m=| 1 |
| 3 |
| 1 |
| 3 |
b.根据反应Ⅱ的特点,如图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线,请指明图2中的压强px=
0.1
0.1
MPa.Na2S2O3·5H2O在化学定量分析中常用作基准物质,实验室制备原理为:2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
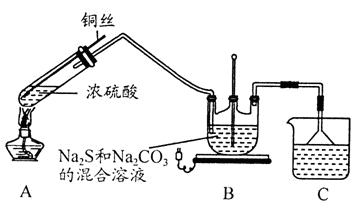
(1)A中发生的化学反应方程式为 。
(2)C中所盛试剂可能是 ;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是 。
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO ②可能是Cu2O ③可能是CuS
学生丙提出假设②一定不成立,依据是 ;该生用如下实验进一步验证黑色物质的组成:
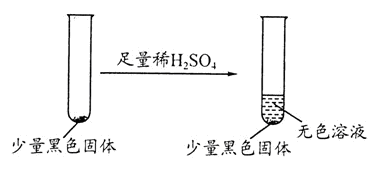
基于上述假设分析,黑色物质的组成为 (填化学式)。
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-)

①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式 ;
②以淀粉为指示剂,则到达滴定终点的现象是 ;
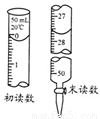
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为 。
查看习题详情和答案>>