摘要:11.缓冲溶液可以抗御少量酸碱对溶液pH的影响.人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3-).维持血液的pH保持稳定.己知在人体正常体温时.反应H2CO3HCO3-+H+的 Ka=10-6.1mol·L-1.正常血液中c(HCO3-):c(H2CO3)≈20:1.lg2=0.3.lg5=0.7.则下列判断正确的是 A.当过量的碱进入血液中时.发生的反应只为:HCO3-+OH-=CO32-+H2O B.由题给数据可算得正常人血液的pH约为7.4 C.血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) D.正常人血液内不会存在以HCO3-/CO32-为主的缓冲体系
网址:http://m.1010jiajiao.com/timu3_id_432629[举报]
缓冲溶液可以抗御少量酸碱对溶液pH的影响。人体血液量最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3-),维持血液的pH稳定。已知在人体正常体温时,反应H2CO3 HCO3-+H+的Ka=10-6.1,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,1g2=0.3。则下列判断正确的是(
)
HCO3-+H+的Ka=10-6.1,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,1g2=0.3。则下列判断正确的是(
)
A.正常人血液内Kw=10-14
B.由题给数据可算得正常人血液的pH约为7.4
C.正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3)[来源:Z.xx.k.Com]
D.当过量的碱进入血液中时,只有发生HCO3-+OH=CO32-+H2O的反应
查看习题详情和答案>>
缓冲溶液可以抗御少量酸碱对溶液pH的影响。人体血液里最主要的缓冲体系是碳酸盐缓冲体系(H2CO3/HCO3-),维持血液的pH保持稳定。己知在人体正常体温时,反应 ,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是 ( )
,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是 ( )
A.当过量的碱进入血液中时,发生的反应只为:HCO3-+OH-=CO32-+H2O
B.由题给数据可算得正常人血液的pH约为7.4
C.血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3)
D.正常人血液内不会存在以HCO3-/CO32-为主的缓冲体系
查看习题详情和答案>>
缓冲溶液可以抗御少量酸碱对溶液pH的影响。人体血液里最主要的缓冲体系是碳酸盐缓冲体系(H2CO3/HCO3-),维持血液的pH保持稳定。己知在人体正常体温时,反应H2CO3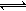 HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( )
HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( )
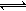 HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( )
HCO3-+H+的Ka=10-6.1,正常血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3,lg5=0.7。则下列判断正确的是( )| A.当过量的碱进入血液中时,发生的反应只为:HCO3-+OH-=CO32-+H2O |
| B.由题给数据可算得正常人血液的pH约为7.4 |
| C.血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3) |
| D.正常人血液内不会存在以HCO3-/CO32-为主的缓冲体系 |