摘要:9.常温下.Ksp=9´10-6.常温下CaSO4在水中的沉淀溶解平衡曲线见图.下列说法正确的是 A.在任何溶液中.c(Ca2+).c(SO42-)均相等 B.b点将有沉淀生成.平衡后溶液中c(SO42-) 一定等于3´10-3 mol·L-1 C.a点对应的Ksp等于c点对应的Ksp D.d点溶液通过蒸发可以变到c点
网址:http://m.1010jiajiao.com/timu3_id_432356[举报]
(2010?泰安二模)已知常温下:KSP(AgCl)=1.8×10-10mol2?L-2,KSP(Ag2CrO4)=1.9×10-12mol3?L-3.则下列叙述正确的是( )
查看习题详情和答案>>
(2011?广东模拟)活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):
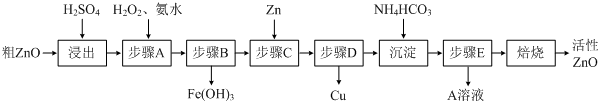
已知:几种离子生成氢氧化物沉淀时的pH如下表:
请问答下列问题:
(1)步骤A加H2O2发生反应的离子方程式是
(2)A溶液中主要含有的溶质是
(3)若经处理后的废水pH=8,此时Zn2+的浓度为
(4)步骤C中加Zn的目的是
查看习题详情和答案>>

已知:几种离子生成氢氧化物沉淀时的pH如下表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
(1)步骤A加H2O2发生反应的离子方程式是
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
,该步骤需控制溶液pH的范围是3.2~5.2
3.2~5.2
.(2)A溶液中主要含有的溶质是
(NH4)2SO4
(NH4)2SO4
.(3)若经处理后的废水pH=8,此时Zn2+的浓度为
0.78
0.78
mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17).(4)步骤C中加Zn的目的是
将Cu2+还原为Cu从而除去Cu2+
将Cu2+还原为Cu从而除去Cu2+
.常温下:Ksp〔Mg(OH)2〕=1.2×10-11mol3?L-3 Ksp(AgCl)=1.8×10-10mol2?L-2Ksp(Ag2CrO4)=1.9×10-12mol3?L-3,
Ksp(CH3COOAg)=2.3×10-3mol2?L-2下列叙述正确的是( )
Ksp(CH3COOAg)=2.3×10-3mol2?L-2下列叙述正确的是( )
查看习题详情和答案>>
(2011?泰州二模)活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):

已知:几种离子生成氢氧化物沉淀时的pH如下表:
请问答下列问题:
(1)步骤A加H2O2发生反应的离子方程式是
(2)A溶液中主要含有的溶质是
(3)碱式碳酸锌经焙烧制得活性ZnO的反应△H>0,该反应能自发进行的原因是△H
(4)若经处理后的废水pH=8,此时Zn2+的浓度为
查看习题详情和答案>>

已知:几种离子生成氢氧化物沉淀时的pH如下表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
(1)步骤A加H2O2发生反应的离子方程式是
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
,该步骤需控制溶液pH的范围是3.2~5.2
3.2~5.2
.(2)A溶液中主要含有的溶质是
(NH4)2SO4
(NH4)2SO4
.(3)碱式碳酸锌经焙烧制得活性ZnO的反应△H>0,该反应能自发进行的原因是△H
>
>
(选填“=”、“>”、“<”)0.(4)若经处理后的废水pH=8,此时Zn2+的浓度为
0.78
0.78
mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17). 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )
常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图.下列说法正确的是( )